Уксусная кислота лимонная кислота: Доступ к этой странице запрещен.
Сила кислоты. О чем Эйнштейн рассказал своему повару
Читайте также
Сила привычек
Сила привычек
И все-таки нужная диета, а точнее – правильная модель питания, которой мы будем следовать, начинается не с бумажки, на которой специалист распишет завтраки, обеды и ужины, размер порций и количество калорий. Стартует новый образ жизни с полного и
Огурцы, маринованные с добавлением лимонной кислоты
Огурцы, маринованные с добавлением лимонной кислоты
На три 3-литровых банки: 4 л воды, 200 г соли, 30 г лимонной кислоты.Кипящей водой заливают огурцы со специями, выдерживают 15–20 мин, воду сливают и заливают кипящим маринадом,
Сила напора
Сила напора
«Когда я открываю бутылку шампанского, оно часто вспенивается и разбрызгивается повсюду, а я не хочу тратить попусту такой дорогой продукт. Почему оно ведет себя таким образом?»Если же вы желаете облить шампанским окружающих, то проще всего сделать это так:
Почему оно ведет себя таким образом?»Если же вы желаете облить шампанским окружающих, то проще всего сделать это так:
В чем сила?
В чем сила?
«Почему микроволновые печи готовят быстрее обычных духовок?»Прежде чем разогреть тот или иной продукт, обычная газовая или электрическая духовка сначала должна нагреть определенный объем воздуха внутри себя (то, что мы называем «предварительно разогреть
Салат «Сила»
Салат «Сила»
Курицу отвариваем, отделяем мясо от костей и мелко нарезаем. Яйца измельчаем, зеленый салат нарезаем соломкой. Добавляем грецкие орехи, сок лимона и майонез. Сухарики кладем перед подачей на стол, чтобы они не размокли.Состав: 1/2 курицы;3 вареных яйца;1 пучок
«Сила самурая»
«Сила самурая»
Ингредиенты1 стакан риса, 1 морковка (большая), 2 стакана воды, 1 луковица, 2–3 лавровых листика, 1/4 стакана растительного масла, 1/3 чайной ложки соли. Способ приготовленияМорковь натрите на терке и смешайте с промытым рисом. Добавьте воду, соль, половину масла.
Способ приготовленияМорковь натрите на терке и смешайте с промытым рисом. Добавьте воду, соль, половину масла.
Правильна ли рекомендация известного американского ученого Лайнуса Полинга о приеме до 10 г в сутки аскорбиновой кислоты?
Правильна ли рекомендация известного американского ученого Лайнуса Полинга о приеме до 10 г в сутки аскорбиновой кислоты?
Лайнус Полинг – выдающийся американский ученый-химик, лауреат двух Нобелевских премий. Рекомендации Полинга основаны на постулатах
Незаменимые кислоты
Незаменимые кислоты
О полиненасыщенных жирных кислотах (ПНЖК) омега-3 мы слышим достаточно часто, однако обычно речь идет о рыбе и морепродуктах (и ненавистном старшему поколению рыбьем жире). О том, что они содержатся в семенах чиа, известно немногим, хотя уже существуют
Омега-3 жирные кислоты
Омега-3 жирные кислоты
Омега-3 – это жирные кислоты, формирующие надежную защиту глаз. У взрослых дефицит незаменимых жирных кислот, особенно омега-3, наносит вред зрению. Дефицит может вызвать изменения в макулярной зоне. В организме эти кислоты преобразуются в
У взрослых дефицит незаменимых жирных кислот, особенно омега-3, наносит вред зрению. Дефицит может вызвать изменения в макулярной зоне. В организме эти кислоты преобразуются в
Незаменимые жирные кислоты
Незаменимые жирные кислоты
Человеческий организм способен синтезировать все нужные ему жиры, кроме двух. Их условно называют омега-3 и омега-6. Они необходимы для осуществления правильного обмена веществ. Если они не поступают с пищей, то клеточное дыхание нарушается,
Кислоты
Кислоты
В состав красного вина входят органические кислоты: яблочная, винная, молочная и другие. От них зависит вкус и аромат продукта, а также его способность бороться с болезнетворными
Омега-3 жирные кислоты для сосудов
Омега-3 жирные кислоты для сосудов
Практически любой человек, интересующийся темой здорового питания, слышал или читал о пользе жирных кислот омега-3. Жиры необходимы нам по многим причинам: составляют основу энергетических резервов организма, входят в состав клеточных
Жиры необходимы нам по многим причинам: составляют основу энергетических резервов организма, входят в состав клеточных
Разница между уксусной кислотой и лимонной кислотой — Разница Между
Уксусная кислота и лимонная кислота являются двумя соединениями, которые часто используются в качестве пищевых добавок. Поэтому эти соединения находятся на кухне; уксусная кислота содержится в уксусе
Основное отличие — уксусная кислота против лимонной кислоты
Уксусная кислота и лимонная кислота являются двумя соединениями, которые часто используются в качестве пищевых добавок. Поэтому эти соединения находятся на кухне; уксусная кислота содержится в уксусе, а лимонная кислота — в соке лайма. Основное различие между уксусной кислотой и лимонной кислотой заключается в том, что уксусная кислота представляет собой одноосновную кислоту, тогда как лимонная кислота представляет собой трехосновную кислоту.
Ключевые области покрыты
1. Что такое уксусная кислота
— определение, свойства, применение
2. Что такое лимонная кислота
– Определение, свойства, приложения
3. Сходство между уксусной кислотой и лимонной кислотой
— Краткое описание общих черт
4. Разница между уксусной кислотой и лимонной кислотой
– Сравнение ключевых различий
Ключевые термины: уксусная кислота, C2ЧАС4О2CH3COOH, C3ЧАС5O (СООН)3, C6ЧАС8О7Лимонная кислота, этановая кислота, молекулярная формула, одноосновная кислота, трехосновная кислота, слабая кислота
Что такое уксусная кислота
Уксусная кислота также известна как Этановая кислота. Он состоит из атомов C, H и O. молекулярная формула уксусной кислоты2ЧАС4О2, Но наиболее распространенным способом представления уксусной кислоты является СН3COOH. Эта формула указывает на некоторые детали о структуре уксусной кислоты. Уксусная кислота является карбоновой кислотой. Он имеет только одну группу карбоновой кислоты. Он состоит из метильной группы (-CH3), который присоединен к атому углерода группы карбоновой кислоты. Молярная масса уксусной кислоты составляет около 60 г / моль.
Эта формула указывает на некоторые детали о структуре уксусной кислоты. Уксусная кислота является карбоновой кислотой. Он имеет только одну группу карбоновой кислоты. Он состоит из метильной группы (-CH3), который присоединен к атому углерода группы карбоновой кислоты. Молярная масса уксусной кислоты составляет около 60 г / моль.
Рисунок 01: Химическая структура уксусной кислоты
При комнатной температуре и давлении уксусная кислота представляет собой бесцветную жидкость с очень резким запахом. Точка кипения этой жидкости составляет около 118оC. pK значение для этой кислоты составляет около 4,76. Следовательно, уксусная кислота является слабой кислотой, и она частично диссоциирует в воде. Но уксусная кислота смешивается с водой.
В водных растворах уксусная кислота диссоциирует, высвобождая атом водорода карбоновой группы в виде Н+ ион. Это причина кислотности уксусной кислоты. Благодаря наличию связи -O-H в карбоксильной группе уксусная кислота может иметь прочные водородные связи в своей твердой фазе.
Уксусная кислота может смешиваться с полярными или неполярными растворителями. Полярная группа уксусной кислоты представляет собой карбоновую группу. Это вызывает смешивание уксусной кислоты с полярными растворителями. Метильная группа является неполярной группой и вызывает смешивание уксусной кислоты с неполярными растворителями.
Применение уксусной кислоты
- Производство уксуса
- Приготовление ацетатов металлов
- Растворители для смол
- Производство уксусного ангидрида
Что такое лимонная кислота
Лимонная кислота является слабой кислотой, чаще всего встречающейся в цитрусовых. Это трикарбоновая кислота с химическая формула С6ЧАС8О7, Распространенным способом представления химической формулы лимонной кислоты является C3ЧАС5O (СООН)3, Это указывает на то, что лимонная кислота имеет три группы карбоновых кислот (-COOH). Помимо этого, также присутствует гидроксильная группа (-ОН).
Молярная масса лимонной кислоты составляет около 192 г / моль. Это соединение без запаха. Лимонная кислота легко кристаллизуется из ее раствора. Эти кристаллы выглядят как белый порошок. Температура кипения лимонной кислоты составляет около 310оC. Лимонная кислота смешивается с водой и безводным этанолом. Благодаря наличию карбоксильных групп лимонная кислота способна образовывать прочные водородные связи.
Рисунок 02: Химическая структура лимонной кислоты
Лимонная кислота является трехосновной кислотой. Он может выпустить три протона (H+) на молекулу. Следовательно, оно имеет три значения pKa. ркa1 составляет 3,13, пкa2 4,76 и рКa3 6,40. Биологическая роль лимонной кислоты — цикл лимонной кислоты; основной метаболический путь животных и растений.
Применение лимонной кислоты
- Используется в качестве пищевой добавки
- Используется как напиток
- Выступать в качестве хелатирующего агента
- Ингредиент некоторых косметики
Рисунок 03: Лимонная кислота используется в приготовлении пищи и напитков
Сходство между уксусной кислотой и лимонной кислотой
- Уксусная кислота и лимонная кислота являются слабыми кислотами.

- Они часто используются в качестве пищевых добавок.
Разница между уксусной кислотой и лимонной кислотой
Определение
Уксусная кислота: Уксусная кислота является полезной слабой кислотой, которая в основном содержится в уксусе.
лимонный Acid: Лимонная кислота — это слабая кислота, содержащаяся в цитрусовых.
кислотность
Уксусная кислота: Уксусная кислота является одноосновной (имеет один замещаемый атом водорода).
лимонный Acid: Лимонная кислота является трехосновной (имеет три сменных атома водорода).
Молярная масса
Уксусная кислота: Молярная масса уксусной кислоты составляет около 60 г / моль.
лимонный Acid: Молярная масса лимонной кислоты составляет около 192 г / моль.
Химическая формула
Уксусная кислота: Химическая формула уксусной кислоты — СН3COOH.
лимонный Acid: Химическая формула лимонной кислоты — C3ЧАС5O (СООН)3.
Количество групп карбоновой кислоты
Уксусная кислота: Уксусная кислота имеет только одну группу карбоновой кислоты.
лимонный Acid: Лимонная кислота имеет три группы карбоновых кислот.
Точка кипения
Уксусная кислота: Точка кипения уксусной кислоты составляет около 118оC.
лимонный Acid: Температура кипения лимонной кислоты составляет около 310оC.
рк
Уксусная кислота: Уксусная кислота имеет только один рК значение.
лимонный Acid: Лимонная кислота имеет три пк ценности.
Заключение
И уксусная кислота, и лимонная кислота являются очень полезными кислотными соединениями. Эти соединения вносят значительный вклад в небольшие применения, а также в крупную промышленность. Основное различие между уксусной кислотой и лимонной кислотой состоит в том, что уксусная кислота представляет собой одноосновную кислоту, тогда как лимонная кислота представляет собой трехосновную кислоту.
Основное различие между уксусной кислотой и лимонной кислотой состоит в том, что уксусная кислота представляет собой одноосновную кислоту, тогда как лимонная кислота представляет собой трехосновную кислоту.
Рекомендации:
1. «Уксусная кислота (Ch4COOH)». Encyclopædia Britannica. Encyclopædia Britannica, inc., N.d. Web.
Уксус, сода, лимонная кислота — чистим бытовую технику тем, что всегда есть в шкафчиках
Беспорядок или какая-то слишком очевидная грязь мозолят глаза и не дают покоя. А вот мелкие неприятности, вроде сталактитов накипи в чайнике или закоптившегося утюга обнаруживаются внезапно и, по закону подлости, в самый неподходящий момент. Химическая промышленность сейчас до того развита, что для каждого типа загрязнения можно найти специальное средство. Но если вы не хотите общаться с консультантами в магазине, тратить деньги или просто не доверяете новым методам, то вот вам мощная подборка вариантов очищения чайника, холодильника, утюга и микроволновки при помощи великолепной тройки — уксуса, соды и лимонной кислоты (ну и парочки других веществ).
Чайник
Если ваш чай приобрел какой-то странный привкус, не спешите ругать производителя, лучше загляните в свой чайник. Скорее всего, он просто зарос накипью. Даже если за неприятным налетом уже даже не видно, какого цвета стенки, это не повод для беспокойства. Отмыть чайник можно средствами, которые практически наверняка есть в вашем домашнем шкафчике.
Уксус
Этот способ эффективен, но при этом очень агрессивен и не все чайники выдерживают такую чистку. Но если у вас очень большой слой накипи, то можно попробовать.
Наливаем в чайник столько воды, чтобы она закрыла всю накипь, и кипятим. Как только чайник отключится, вливаем в воду уксус (чуть меньше 1 стакана). Закрываем крышку и оставляем на час. Вынесите чайник подальше от людей и домашних животных, потому что уксус будет резко пахнуть.
Как правило, после такой чистки накипь отлично растворяется, но если у вас все совсем запущено, то она может только разрыхлиться, это нестрашно. Протрите губкой и налет легко отойдет.
Протрите губкой и налет легко отойдет.
После чистки тщательно промойте чайник, а потом несколько раз вскипятите в нем воду и вылейте.
Лимонная кислота
Хорошо снимет средние или мелкие загрязнения.
Как и в предыдущем варианте наливаем воду в чайник так, чтобы закрывала отложения, кипятим. В кипяток засыпаем лимонную кислоту (1-2 столовые ложки), и ждем, пока вода остынет. Вы можете периодически заглядывать в чайник, часто бывает, что накипь разъедается до того, как вода остынет.
После также промываем чайник и несколько раз кипятим воду в нем.
Сода
Если у вас эмалированный или алюминиевый чайник, то варианты с кислотой вам не подойдут. Зато вполне можно произвести чистку содой.
Смешайте соду (1 ст. ложка) с водой (примерно 500 мл), вскипятите этот раствор и варите на слабом огне 30 мин. После чего выливайте смесь, а затем несколько раз прокипятите чистую воду в чайнике и тщательно его промойте.
Если у вас электрочайник, то вскипятите в нем содовый раствор, затем дайте остыть. Вряд ли сода полностью разъест всю накипь, но она станет мягче и легко снимется губкой.
Вряд ли сода полностью разъест всю накипь, но она станет мягче и легко снимется губкой.
Очистки яблок или картошки
Подходит только для очень слабого налета.
Тщательно промытые очистки складываем в чайник, заливаем водой и кипятим. Затем оставляем на 1-2 часа. Налет должен размягчиться и снова его будет довольно просто отмыть губкой.
Рассол
Этим способом можно очистить поверхность в том числе и от ржавчины.
Процеживаем рассол, чтобы в чайник не попали специи, укроп, кусочки чеснока. Кипятим и оставляем остывать. Смываем размягчившуюся известь губкой и хорошенько промываем чайник.
Утюг
Грязная подошва утюга – это не только неэстетично, но и опасно. Ведь она может навсегда испортить любимые вещи. Если вы заметили, что ваш утюг слегка «поджарен», обязательно приступайте к его чистке.
Соль
Насыпаем на белый лист бумаги ровным слоем соль и «утюжим» ее, пока подошва не станет чистой.
Парафиновая свеча
Сейчас большинство декоративных свечей именно парафиновые. Обворачиваем свечку х/б тканью. И этим «карандашом» круговыми движениями чистим подошву раскаленного утюга. Только учтите, что парафин будет плавиться и капать, поэтому подстелите что-нибудь.
Обворачиваем свечку х/б тканью. И этим «карандашом» круговыми движениями чистим подошву раскаленного утюга. Только учтите, что парафин будет плавиться и капать, поэтому подстелите что-нибудь.
Такой способ не очень подойдет для утюгов с рельефной поверхностью, потому что парафин может забиться в неровности и при последующей глажке испортит ваши вещи.
Перекись водорода
Смачиваем ватный диск 3%-ной перекисью водорода. Трем поверхность холодного утюга. Этот способ не очень приятный, так как придется прилагать усилия.
Уксус
Делаем то же самое, что в предыдущем совете, только с уксусом. Можно также просто накрыть подошву утюга пропитанной уксусом тканью и оставить это все на несколько часов. Затем стираем размягчившуюся грязь губкой.
Сода
Растворяем несколько ложек соды в стакане воды, смачиваем в этом растворе кусок ткани и протираем им холодный утюг. Затем влажной губкой смываем остатки соды.
Растворите несколько ложек соды в стакане воды, смочите в этом растворе кусок материи и протирайте им холодную поверхность утюга. По окончании очистите утюг от разводов влажной губкой.
По окончании очистите утюг от разводов влажной губкой.
Холодильник
Даже самые вкусные блюда не захочется брать, если они будут стоять в неприятно пахнущем холодильнике. Он может стать «ароматным» по разным причинам, но избавиться от этой напасти можно при помощи все тех же «народных средств».
Уксус
Разводим уксус водой в соотношении 50 на 50. Смачиваем в этом растворе тряпочку и протираем стенки холодильника.
Сода
Так же разводим соду с водой, промываем холодильник. Затем протираем от остатков соды.
Нашатырный спирт
К этому способу лучше прибегать, когда уже ничто не помогает.
Разводим с водой 50 на 50, смачиваем тряпочку и протираем стенки холодильника.
Уголь
Если запах в холодильнике появился, например, из-за испортившегося продукта или неприкрытого чеснока, можно воспользоваться углем активированным или древесным.
Уголь размельчаем и оставляем в холодильнике на сутки.
размельчите древесный или активированный уголь и поместите его на блюдце в холодильник на сутки — он впитает в себя резкий запах;
Микроволновка
Если у вас нет привычки накрывать разогреваемые блюда крышкой, значит, проблема очистки стенок микроволновой печи будет возникать довольно регулярно. Рассказываем, как облегчить эту неприятную процедуру.
Вода
Берем миску, наполняем водой и ставим ее в микроволновку на максимальную мощность. Пар размягчит загрязнения, а нам надо будет лишь смахнуть их губкой. А затем насухо протереть камеру.
Средство для мытья посуды
Растворяем несколько капель моющего средства в воде и помещаем емкость в камеру. Включаем микроволновку на полную мощность и доводим раствор до кипения. Затем смываем остатки грязи и протираем насухо.
Сода
Разведите из соды и воды немного кашицы. Натрите ею дверцу микроволновки и стенки. Оставьте на 30 мин. Смойте.
Кислота
Микроволновку также можно почистить уксусом или лимонной кислотой. Наливам стакан воды в тарелку, добавляем столовую ложку лимонной кислоты. Включаем на полную мощность, доводим до кипения раствор. Протираем влажной губкой стенки.
Наливам стакан воды в тарелку, добавляем столовую ложку лимонной кислоты. Включаем на полную мощность, доводим до кипения раствор. Протираем влажной губкой стенки.
Как удалить известковый налет в ванной
Как удалить известковый налет в ванной. Если на поверхности сантехники виден след известкового налета, это значит, что в вашу квартиру подается жесткая вода. К сожалению, во многих регионах России этот вопрос практически неразрешим.
Людям, пользующимся жесткой водой приходится периодически бороться с этим известковым налетом, чтобы содержать сантехническую кабину в приличном состоянии. Если оставить все как есть¸ то сантехнические приборы: ванна, смеситель или душевая кабина будут иметь неприглядный вид и будут все больше зарастать известняком.
Поставщики бытовой химии зарабатывают приличные дивиденды на продаже специальных составов для уничтожения известкового налета. Стоимость подобной химической продукции не дешевая, а необходимый эффект после обработки ими сантехники достигается не всегда.
Удалить известковый налет в ванной
Тем не менее, когда новое средство неплохо удаляет известковый налет, часто данное средство имеет незаслуженно высокую цену. Откроем вам маленький секрет: в состав дорогостоящих гелей для борьбы с налетом входят три вида кислот: лимонная, щавелевая и уксусная кислоты.
Эти кислоты доступны и не дороги, а уничтожают известковый налет не хуже дорогостоящих гелей. Ниже рассмотрим, как удалить налет известняка, используя данные кислоты. Как же действуют эти кислоты на разные виды материалов.
Уксусная кислота
Начнем с уксусной кислоты. Мы рассматриваем не обычный столовый уксус, уксусную кислоту в чистом виде, либо эссенцию 25% концентрации. Способ ее приготовления следующий. Эссенцию разводят в воде. Придерживаясь соотношения один к двадцати.
Если известняк плотный, то температура воды для приготовления раствора должна быть высокой. При самых тяжелых случаях уксус рекомендуется разводить только что закипевшей водой.
Когда вы обрабатываете «зараженную» поверхность уксусной кислотой будьте максимально осторожны, не допускайте попадание раствора на открытые участки кожи. Обработку следует проводить, надев на руки резиновые перчатки.
Обработку следует проводить, надев на руки резиновые перчатки.
Раствором уксусной кислоты отлично убирается налет изделий, изготовленных из фаянса, стекла, никеля или эмалированной сантехники. Нельзя использовать уксусную кислоту при обработке акриловых ванн и пластиковых стенок душевых кабин.
Щавелевая кислота
Щавелевая кислота также применяется в составе воды. Готовить раствор щавелевой кислоты нужно, используя теплую воду.
Процентное соотношение щавелевой кислоты к воде то же – один к двадцати. Раствор используется при обработке стеклянных изделий, пластика и санфаянса. Считается, что чугунные ванны, также можно чистить подобным раствором, но производители в инструкциях по эксплуатации ванн запрещают данный способ чистки.
Раствор щавелевой кислоты наносят на поверхность щеткой и дают ей отстояться около трех часов, чтобы раствор мог воздействовать на налет известняка. После этого поверхность промывают проточной водой.
Лимонная кислота
Лимонная кислота считается самой «спокойной» . Лимонная кислота подойдет для использования на любых поверхностях. Ее можно использовать, например, для чистки изделий их сантехнического акрила и любой ванны.
Лимонная кислота подойдет для использования на любых поверхностях. Ее можно использовать, например, для чистки изделий их сантехнического акрила и любой ванны.
Для удаления известняка можно использовать обычную столовую лимонную кислоту. Готовят раствор лимонной кислоты следующим образом: в 0,5 литра теплой воды добавляем пакет лимонной кислоты.
Следует тщательно перемешать данный состав, чтобы кислота растворилась в воде полностью. Процесс удаления известкового налета лимонной кислотой аналогичен использованию раствора щавелевой кислоты.
Как удалить известковый налет в ванной? Купила квартиру, ванная запущена, кругом на смесителях известковый налет. Некрасиво.
Как удалить известковый налет подробно описано в этой статье.
Как удалить известковый налет в ванной.
Удаление накипи
Как вы знаете из школьного курса химии, ионы кальция и магния содержатся в обыкновенной воде. Повышенное содержание ионов Са2+и Mg2+придаёт воде отрицательное качество, называемое жёсткостью.
Содержащиеся в природе нерастворимые в воде карбонаты магния и кальция под воздействием воды и присутствующего в воздухе углекислого газа способны превращаться в гидрокарбонаты, которые хорошо растворяются в воде и вызывают карбонатную или временную жесткость:
СаСО3+ СО2+ Н2О= Са(НСО3)2
MgСО3+ СО2+ Н2О= Mg(НСО3)2
Этот процесс широко осуществляется в природных условиях, приводя к выносу размываемых известняков в поверхностные воды, а затем – в моря и океаны.
При кипячении растворимые гидрокарбонаты Са(НСО3)2и Mg(НСО3)2переходят в нерастворимые карбонаты и выпадают в осадок в виде накипи:
Са(НСО3)2 = CaCO3↓ + H2O + CO2↑
Mg(НСО3)2 = MgCO3↓ + H2O + CO2↑
Таким образом, накипь, в основном, состоит из карбонатов кальция и магния. Задача — перевести их в растворимое состояние, используя химические свойства карбонатов, а именно, взаимодействие с кислотами. Но, с тем чтобы не разрушить металлические детали стиральных машин и чайники необходимо для этих целей использовать слабые органические кислоты: лимонную, уксусную и др.
Задача — перевести их в растворимое состояние, используя химические свойства карбонатов, а именно, взаимодействие с кислотами. Но, с тем чтобы не разрушить металлические детали стиральных машин и чайники необходимо для этих целей использовать слабые органические кислоты: лимонную, уксусную и др.
CaCO3 + 2СН3СООН = (СН3СОО)2Са + Н2О + СО2↑
где (СН3СООН) уксусная кислота
Удаление накипи с помощью уксусной кислоты
В чайник примерно на две трети налить воды, на одну треть — 9%-го раствора уксусной кислоты. Раствор вскипятить, потом оставить его в чайнике до полного охлаждения или просто на несколько часов. После этого воду можно слить, а чайник промыть от остатков накипи. Если накипь осталась, процедуру повторяют. Перед дальнейшим использованием чайника обязательно нужно предварительно прокипятить в нем воду, чтобы избавиться от запаха уксуса.
Удаление накипи с помощью лимонной кислоты
Чайник необходимо наполнить раствором лимонной кислоты из расчета 10г на 1л. Следует указать, что в обычной магазинной расфасовке пакетик лимонной кислоты содержит 25 г продукта, поэтому для упрощения расчетов можно использовать 1 пакетик на полный чайник воды. Полученный раствор довести да кипения. Сразу же, как только вода начнет закипать, чайник нужно выключить, так как при кипении вода будет сильно пениться и, вероятнее всего, начнет выплескиваться через верх. Горячий раствор оставить на некоторое время в чайнике. После этого жидкость нужно вылить, остатки накипи очистить щеткой и тщательно промыть чайник водой. Если после процедуры налет полностью не удалился, то желательно повторить ее снова.
Следует указать, что в обычной магазинной расфасовке пакетик лимонной кислоты содержит 25 г продукта, поэтому для упрощения расчетов можно использовать 1 пакетик на полный чайник воды. Полученный раствор довести да кипения. Сразу же, как только вода начнет закипать, чайник нужно выключить, так как при кипении вода будет сильно пениться и, вероятнее всего, начнет выплескиваться через верх. Горячий раствор оставить на некоторое время в чайнике. После этого жидкость нужно вылить, остатки накипи очистить щеткой и тщательно промыть чайник водой. Если после процедуры налет полностью не удалился, то желательно повторить ее снова.
Как очистить стиральную машину от накипи лимонной кислотой
Для удаления накипи в стиральных машинах используется лимонная кислота, которая продается во всех продуктовых магазинах. Строгое соблюдение пропорции – обязательно, в противном случае все резиновые части машины будут безвозвратно повреждены.
Суть заключается в том, что надо прогнать машину в рабочем режиме, но только без белья. В лоток для порошка насыпается лимонная кислота в количестве 2-3 столовых ложек. Выбирается программа с самой высокой температурой (обычно – 90-950С) и самым продолжительным циклом. В результате ТЭН, внутренняя часть агрегата полностью очищаются и блестят, как новые.
В лоток для порошка насыпается лимонная кислота в количестве 2-3 столовых ложек. Выбирается программа с самой высокой температурой (обычно – 90-950С) и самым продолжительным циклом. В результате ТЭН, внутренняя часть агрегата полностью очищаются и блестят, как новые.
Процедуру с лимонной кислотой можно повторять один раз в три месяца. Она снимет накипь, экономит расход электроэнергии, дает многим деталям прослужить дольше, если лимонной кислоты вы будете брать не больше, чем написано в существующем рецепте.
Используя домашние методы очищения от накипи можно получить практически идеальный результат, не тратя много времени и средств.
Плотность водных растворов органических кислот: муравьиная кислота, уксусная кислота, трихлоруксусная кислота, молочная кислота, лимонная кислота при 20°C в зависимости от массовой доли (%)
Навигация по справочнику TehTab.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
TehTab.ru Реклама, сотрудничество: info@tehtab.ru | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Лимонная кислота оптом с доставкой по России
Лимонная кислота
Купить оптом лимонную кислоту в России, Белоруссии, Казахстане, Монголии, Азербайджане, оптом и в розницу.
Платежные условия обсуждаются индивидуально, мы всегда готовы пойти Вам навстречу.
- Завод производитель: Китай.
- Используется: Росва.
Стоимость
| Наименование | ГОСТ | Цена с НДс за тонну, руб |
|---|---|---|
| Лимонная кислота | Китай | от 84 000 |
Применение
- Пищевая промышленность (65% от всего объема использования),
- изготовление косметики (15% от всего объема использования)-выступает компонентом кремов, пилингов, лосьонов, мыла, пенок, шампуней, красок для волос и т.д.,
- Виноделие — С помощью лимонной кислоты устраняют помутнения вина и других алкогольных напитков,
- Фармакология — вещество замедляет свертываемость донорской крови, улучшает ее консервацию и повышает сохранность, она входит в состав стоматологических отбеливающих составов,
- металлургия — задействуется при электротравлении меди,
- легкая промышленность — участвует в ситцевании (нанесении рисунка на ткань),
- нефтегазовый комплекс — в ходе бурения скважин применяют моногидрат лимонной кислоты ради нейтрализации цемента, а также для нормализации liH воды, предназначенной для разбавления бетонита.

Отправить заявку
Наши преимущества и гарантии
Безопасная доставка
Емкости сертифицированы в соответствии с ДОПОГ.
Водители прошли обучение по работе с ОГ (ДОПОГ).
Строгое соблюдение сроков
Ваш груз будет доставлен в нужное вам время и место.
Всегда в наличии
Вся продукция есть на складе в г. Воскресенск
География поставок
- Финляндия
- Белоруссия
- Казахстан
- Россия
- Азербайджан
Дистрибьютор №1 завода Kemira в России
Посмотреть
сертификат
Типы тары для доставки лимонной кислоты
ЖД цистерна
Автоцистерна
Мелкогабаритные
Доставка
Доставляем авто и железнодорожным транспортом от 1 тонны, самовывоз от 1кг.
Вся продукция на складе емкости от 1л до 60тонн сертифицированы ДОПОГ.
Работаем с юридическими и физическими лицами.
Возможна доставка в течение суток с момента оформления заявки.
Самовывоз
© 2015 АО «ТРАНСКЕМИКЛ-экспресс»
140207, МО, Воскресенский р-н,
дер. Ратмирово, ул. Набережная, д. 6
ОГРН: 1055000816078
ИНН: 5005041909
Сравнение влияния лимонной кислоты и уксусной кислоты в качестве имитатора кислых пищевых продуктов на выделение компонентов сплава из нержавеющей стали AISI 201
Основные моменты
- •
Исследован новый европейский тест для металлов и сплавов, контактирующих с пищевыми продуктами.
- •
0,3% лимонная кислота более агрессивна к AISI 201 по сравнению с 3% уксусной кислотой.
- •
Первоначальное высвобождение металла и пассивация поверхности из-за образования комплекса с цитратом металла.

- •
Выделение металла из нержавеющей стали AISI 201 ниже установленных пределов.
- •
Параметры испытаний для конкретного приложения сильно влияют на выделение металла.
Реферат
Для обеспечения безопасности металлов и сплавов, предназначенных для контакта с пищевыми продуктами, в 2013 году был опубликован новый европейский протокол испытаний (протокол CoE) с использованием лимонной кислоты в качестве имитатора пищевых продуктов. В этом исследовании изучалось влияние лимонной кислоты и условия воздействия на выделение металла из аустенитной марганцевой нержавеющей стали (AISI 201).Воздействие лимонной кислоты 5 г / л привело к значительно более низким выбросам металлов по сравнению с конкретными пределами выделения, установленными протоколом CoE. Лимонная кислота 5 г / л (0,3 об.%) Была более агрессивной, чем 3 об.% Уксусной кислоты (итальянский протокол) из-за более высокого комплексообразования с металлами. Исследования шлифованных поверхностей показали, что большинство металлов выделяется в течение первых 0,5 ч воздействия из-за пассивации поверхности. Истирание поверхности, повышенная температура (40–100 ° C), увеличенное соотношение площади поверхности к объему раствора (0.25–2 см 2 / мл) и повышенная концентрация лимонной кислоты (0–21 г / л) — все это привело к увеличению количества выделяемого металла.
Исследования шлифованных поверхностей показали, что большинство металлов выделяется в течение первых 0,5 ч воздействия из-за пассивации поверхности. Истирание поверхности, повышенная температура (40–100 ° C), увеличенное соотношение площади поверхности к объему раствора (0.25–2 см 2 / мл) и повышенная концентрация лимонной кислоты (0–21 г / л) — все это привело к увеличению количества выделяемого металла.
Ключевые слова
Аустенитная нержавеющая сталь
Контакт с пищевыми продуктами
Протокол CoE
Методические указания
Комплексообразование
Выделение металла
Поверхностный оксид
Рекомендуемые статьи Цитирующие статьи (0)
Просмотреть аннотацию Авторы © 2014 Опубликовано Elsevier Ltd.
Рекомендуемые статьи
Цитирующие статьи
Сравнение влияния лимонной кислоты и уксусной кислоты в качестве имитатора кислой пищи на выделение компонентов сплава из нержавеющей стали AISI 201
электрохимические свойства и выделение металла из распыленной Порошки из нержавеющей стали 316L
. Int. J. Electrochem. Sci. 7 (12), 11655–11677.
Int. J. Electrochem. Sci. 7 (12), 11655–11677.
Хедберг, Ю., Одневалл Валлиндер, И., 2012. Исследования трансформации / растворения
выделения железа и хрома из частиц сплавов по сравнению с их чистыми металлами
и отдельными оксидами металлов. Mater. Коррос. 63 (6), 481–491.
Хедберг, Ю., Одневалл Валлиндер, И., 2014. Выделение металла и видообразование выделенного хрома
из биомедицинского сплава CoCrMo в смоделированные физиологически соответствующие растворы
.J. Biomed. Mater. Res. B Прил. Биоматр. 102 (4), 693–699.
Хертинг, Г., Одневалл Валлиндер, И., Лейграф, К., 2006. Факторы, которые влияют на выделение металлов
из нержавеющих сталей, подвергающихся воздействию физиологических сред. Коррос.
Sci. 48 (8), 2120–2132.
Хертинг, Г., Одневалл Валлиндер, И., Лейграф, К., 2008a. Вызванное коррозией выделение хрома
и железа из ферритной нержавеющей стали марки AISI 430 при контакте с имитацией пищевых продуктов
. Дж.Food Eng. 87 (2), 291–300.
Дж.Food Eng. 87 (2), 291–300.
Хертинг, Г., Одневалл Валлиндер, И., Лейграф, К., 2008b. Коррозионное выделение
основных легирующих компонентов марганцево-хромистых нержавеющих сталей в
различных средах. J. Environ. Монит. 10, 1084–1091.
ISSF, 2005. Стали «новой серии 200»: возможность или угроза для имиджа нержавеющей стали
?,
PDF / ISSFNew200seriessteelsAnopportunityorathreat_EN.pdf>.
Текст итальянского закона, 1973 г. Decreto Ministeriale 21.03.1973, гигиенические условия
упаковки, тары и предметов, предназначенных для контакта с
пищевыми продуктами или веществами, используемыми людьми.
Дженсен, К.С., Лисби, С., Баадсгаард, О., Бириалсен, К., Менне, Т., 2003. Выделение ионов никеля
из сплавов нержавеющей стали, используемых в стоматологических скобах, и их заплаточный тест
реактивность в люди, чувствительные к никелю. Контактный дерматит 48 (6), 300–304.
Камеруд, К.Л., Хобби, К.А., Андерсон, К.А., 2013. Нержавеющая сталь выщелачивает никель и
хром в продукты во время приготовления. J. Agric. Food Chem. 61 (39), 9495–9501.
Карими, С., Никки, Т., Альфантази, А.М., 2012. Долгосрочное исследование коррозии сплавов
AISI 316L, Co – 28Cr – 6Mo и Ti – 6Al – 4V в растворах с моделируемыми телами.
Заяв. Серфинг. Sci. 258 (16), 6087–6096.
Коцян А., Милошев И., Пихлар Б., 2003. Влияние комплексообразователя и белков
на коррозию нержавеющих сталей и их металлических компонентов.J.
Mater. Sci. — Матер. Med. 14 (1), 69–77.
Кремер Л.В., 2004. Усовершенствования пассивации с использованием рецептур лимонной кислоты,
Конференция «Материалы и процессы для медицинских устройств». Asm Intl, 87–90.
Кулиговски Дж., Гальперин К., 1992. Посуда из нержавеющей стали как значительный источник
никеля, хрома и железа. Arch. Environ. Contam. Toxicol. 23 (2), 211–215.
Lambert, W.J., 1990. BUFCALC: программа для расчета буферов с заданным pH
, ионной силой и буферной емкостью.J. Chem. Educ. 67 (2), 150.
Lin, T.-I., Lee, Y.-H., Chen, Y.-C., 1993. Капиллярный электрофоретический анализ неорганических катионов
: роль комплексообразователя и буфера pH. J. Chromatogr. A 654 (1), 167–
176.
Ливингстон, E.H., 2004. Кто был студентом и почему мы так заботимся о его тесте t-
? J. Surg. Res. 118 (1), 58–65.
Милошев И., 2002. Влияние комплексообразователей на электрохимическое поведение ортопедической нержавеющей стали
в физиологическом растворе.J. Appl. Электрохим. 32
(3), 311–320.
Невилл, А., Ходжкисс, Т., 1996. Оценка коррозионного поведения сплавов высокой марки
в морской воде при повышенной температуре и при высокой скорости потока.
. Коррос. Sci. 38 (6), 927–956.
Окадзаки, Ю., Гото, Э., 2005. Сравнение высвобождения металлов из различных металлических биоматериалов
in vitro. Биоматериалы 26 (1), 11–21.
Биоматериалы 26 (1), 11–21.
Олссон, C.-O.A., Ландольт, Д., 2003.Пассивные пленки на нержавеющих сталях — химия,
структура и рост. Электрохим. Acta 48, 1093–1104.
Пауэрс, округ Колумбия, Хиггс, А.Т., Обли, М.Л., Лебер, П.А., Хесс, К.Р., Йодер, К.Х., 2005.
Анализ природных буферных систем и воздействия кислотных дождей. Экологический проект
для студентов первого курса химии. J. Chem. Educ. 82 (2),
274.
Седрикс, А.Дж., 1996. Коррозия нержавеющих сталей, второе изд. John Wiley & Sons Inc.,
Нью-Йорк.
Simoneau, C., 2009. Руководство по условиям тестирования изделий, контактирующих с продуктами питания
(с акцентом на кухонную утварь) — Публикация CRL-NRL-FCM, 1-е издание
, 2009 г. Офис официальных публикаций в Европе Сообщества,
Thyssen, J.P., Menne
´, T., 2010. Аллергия на металлы — обзор воздействия, проникновения,
генетики, распространенности и клинических последствий. Chem. Res. Toxicol. 23 (2), 309–
Chem. Res. Toxicol. 23 (2), 309–
318.
Урбанский, Э.Т., Шок, М.Р., 2000. Понимание, получение и вычисление емкости буфера
. J. Chem. Educ. 77 (12), 1640.
ВОЗ, 1996. Микроэлементы в питании и здоровье человека (Отчет о повторной оценке роли микроэлементов в здоровье и питании человека
),
apps.who.int/iris/bitstream/10665/37931/1/9241561734_eng.pdf>. Всемирный
Организация здравоохранения, Женева, Швейцария.
ВОЗ, 2011. Руководство по качеству питьевой воды,
water_sanitation_health / Publications / 2011 / dwq_guidelines / en / index.html>,
, четвертое издание. Всемирная организация здоровья.
Виртанен, С., Милошев, И., Гомес-Баррена, Э., Требсе, Р., Сало, Дж., Конттинен, Ю.Т., 2008.
Специальные режимы коррозии в физиологических и смоделированных физиологических условиях
. Acta Biomater. 4, 468.
Чжан Ю., Каллай Н., Матиевич Э., 1985. Взаимодействие гидроксидов металлов с хелатирующими агентами
. 7. Системы гематит-щавелевая и-лимонная кислота. Langmuir
7. Системы гематит-щавелевая и-лимонная кислота. Langmuir
1 (Copyright (C) Американское химическое общество (ACS), 2010. Все права защищены.),
201–206.
Н. Мазинанян и др. / Journal of Food Engineering 145 (2015) 51–63 63
Лимонный сок или уксус: что более кислое?
При разработке нашей 10-минутной рикотты мы исследовали причину и действие этих двух кислот; плюс наслаждайтесь этим сливочным сыром по четырем нашим любимым рецептам
Ангус Фергюссон
Разработка нашей кремовой 10-минутной истории с рикоттой для мартовского номера была очень интересной, мы также многому научились в процессе.Приготовить рикотту очень просто, если у вас есть именно те ингредиенты. И, приготовив рикотту дома, вы больше никогда не захотите покупать ее в продуктовом магазине — домашняя версия — , что хорошо.
Что такое рикотта?
Рикотта — это незрелый сыр, получаемый путем нагревания молока и отделения сухих веществ молока от сыворотки посредством процесса, называемого коагуляцией. Коагуляция происходит, когда белки, в данном случае твердые вещества молока, подвергаются повышенному нагреванию и в них вводится кислота.Когда в молоке происходит коагуляция, твердые частицы сжимаются и становятся более твердыми, образуя белые частицы, которые отделяются от желтоватой мутной жидкости — сыворотки.
Коагуляция происходит, когда белки, в данном случае твердые вещества молока, подвергаются повышенному нагреванию и в них вводится кислота.Когда в молоке происходит коагуляция, твердые частицы сжимаются и становятся более твердыми, образуя белые частицы, которые отделяются от желтоватой мутной жидкости — сыворотки.
Что мы узнали?
Кухня Chatelaine проверила наш рецепт кремовой рикотты несколько раз и выяснила, что все кислоты не взаимозаменяемы. Количество и тип используемой кислоты имеют решающее значение для кремообразной, гладкой и вкусной рикотты. При приготовлении рикотты можно использовать разные кислоты, для некоторых методов требуется уксус (его тоже может быть широкий диапазон), а для других — лимонный сок.Мы протестировали с белым уксусом и лимонным соком и обнаружили, что лимонный сок делает рикотту более кремовой, гладкой и вкусной. Наши испытания показали, что уксус дает более твердый и немного более жесткий продукт. Общее правило замены лимонного сока — использовать половину количества уксуса. Хотя, когда мы тестировали рецепт с половиной количества уксуса, результаты все равно бледнеют по сравнению с результатами с лимонным соком. Кухня Chatelaine — это отчасти лаборатория, отчасти кухня, поэтому нам пришлось выяснить, почему две похожие кислоты реагируют так по-разному.
Хотя, когда мы тестировали рецепт с половиной количества уксуса, результаты все равно бледнеют по сравнению с результатами с лимонным соком. Кухня Chatelaine — это отчасти лаборатория, отчасти кухня, поэтому нам пришлось выяснить, почему две похожие кислоты реагируют так по-разному.
В чем разница между лимонным соком и уксусом?
Наиболее существенное различие между лимонным соком и уксусом — это тип кислоты. Лимонный сок в среднем состоит из пяти-шести процентов лимонной кислоты. С другой стороны, уксус состоит из уксусной кислоты. В процентном отношении это зависит от уксуса. Белый уксус, как правило, содержит семь процентов уксусной кислоты, что выше, чем в других уксусах. Немного более мягкие уксусы, такие как бальзамический и красный винный уксус, содержат около шести процентов, а относительно мягкий рисовый винный уксус — около четырех с половиной процентов (ни один из которых вы не использовали бы для рикотты).Что касается pH, уксус немного более кислый, чем лимонный сок.
Поскольку кислотность является катализатором коагуляции, мы можем только предположить, что этот немного более высокий уровень кислотности в уксусе заставил наши белки (твердые вещества молока) стать более твердыми, жесткими и сухими. Также существует вероятность того, что разные кислоты (уксусная или лимонная) по-разному реагируют с молоком. Наконец, нельзя не учитывать влияние аромата. Лимонный сок, казалось, производил прекрасный, мягкий, нежный аромат.
Четыре способа использования рикотты:
Как я уже упоминал, после того, как вы попробуете нашу домашнюю рикотту, вы уже не захотите возвращаться к упакованному разнообразию.Домашняя рикотта хранится в холодильнике в течение недели, поэтому используйте ее по максимуму и попробуйте некоторые из следующих рецептов: жареные помидоры кростини, пицца с маслом и курицей, рикотта и лимонные баклажаны инвертини, оладьи с рикоттой и овсяными отрубями с кленово-малиновым соусом
Первоначально опубликовано 15 февраля 2012 г.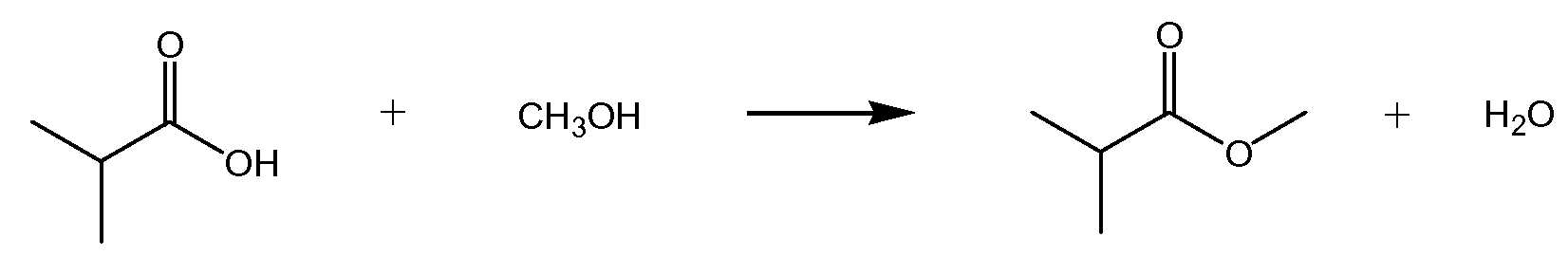
Разница между уксусной кислотой и лимонной кислотой
Основное различие — уксусная кислота и лимонная кислота
Уксусная кислота и лимонная кислота — два соединения, которые часто используются в качестве пищевых добавок.Поэтому эти составы встречаются на кухне; уксусную кислоту можно найти в уксусе, а лимонную кислоту можно найти в соке лайма. Основное различие между уксусной кислотой и лимонной кислотой состоит в том, что уксусная кислота является одноосновной кислотой, тогда как лимонная кислота является трехосновной кислотой.
Основные зоны покрытия
1. Что такое уксусная кислота
— Определение, свойства, применение
2. Что такое лимонная кислота
— Определение, свойства, применение
3.Сходства между уксусной кислотой и лимонной кислотой
— Краткое описание общих характеристик
4. Разница между уксусной кислотой и лимонной кислотой
Разница между уксусной кислотой и лимонной кислотой
— Сравнение основных различий
Ключевые термины: уксусная кислота, C 2 H 4 O 2 , CH 3 COOH, C 3 H 5 O (COOH) 3 , C 6 H 8 O 7 , лимонная кислота, этановая кислота, молекулярная формула, одноосновная кислота, трехосновная кислота, слабая кислота
Что такое уксусная кислота
Уксусная кислота также известна как этановая кислота.Он состоит из атомов C, H и O. Молекулярная формула уксусной кислоты: C 2 H 4 O 2 . Но наиболее распространенным способом представления уксусной кислоты является CH 3 COOH. Эта формула указывает на некоторые детали структуры уксусной кислоты. Уксусная кислота — это карбоновая кислота. Он имеет только одну группу карбоновой кислоты. Он состоит из метильной группы (-CH 3 ), которая присоединена к атому углерода группы карбоновой кислоты. Молярная масса уксусной кислоты составляет около 60 г / моль.
Молярная масса уксусной кислоты составляет около 60 г / моль.
Рисунок 01: Химическая структура уксусной кислоты
При комнатной температуре и давлении уксусная кислота представляет собой бесцветную жидкость с очень резким запахом. Температура кипения этой жидкости составляет около 118 o ° C. Значение pK для этой кислоты составляет около 4,76. Следовательно, уксусная кислота является слабой кислотой и частично диссоциирует в воде. Но уксусная кислота смешивается с водой.
В водных растворах уксусная кислота диссоциирует, высвобождая атом водорода карбоксильной группы в виде иона H + .Это причина кислотности уксусной кислоты. Из-за наличия связи –O-H в карбоксильной группе уксусная кислота может иметь сильные водородные связи в твердой фазе.
Уксусная кислота может смешиваться как с полярными, так и с неполярными растворителями. Полярная группа уксусной кислоты представляет собой карбоксильную группу. Это вызывает смешивание уксусной кислоты с полярными растворителями. Метильная группа является неполярной группой и вызывает смешивание уксусной кислоты с неполярными растворителями.
Это вызывает смешивание уксусной кислоты с полярными растворителями. Метильная группа является неполярной группой и вызывает смешивание уксусной кислоты с неполярными растворителями.
Применение уксусной кислоты
- Производство уксуса
- Получение ацетатов металлов
- Растворители для смол
- Производство уксусного ангидрида
Что такое лимонная кислота
Лимонная кислота — это слабая кислота, наиболее часто встречающаяся в цитрусовых.Это трикарбоновая кислота с химической формулой C 6 H 8 O 7 . Обычный способ представления химической формулы лимонной кислоты: C 3 H 5 O (COOH) 3 . Это указывает на то, что лимонная кислота имеет три группы карбоновых кислот (-COOH). Кроме того, также присутствует гидроксильная группа (-ОН).
Молярная масса лимонной кислоты составляет около 192 г / моль. Это соединение без запаха. Лимонная кислота легко кристаллизируется из ее раствора.Эти кристаллы выглядят как белый порошок. Температура кипения лимонной кислоты составляет примерно 310 o C. Лимонная кислота смешивается с водой и безводным этанолом. Благодаря наличию карбоксильных групп лимонная кислота способна образовывать прочные водородные связи.
Лимонная кислота легко кристаллизируется из ее раствора.Эти кристаллы выглядят как белый порошок. Температура кипения лимонной кислоты составляет примерно 310 o C. Лимонная кислота смешивается с водой и безводным этанолом. Благодаря наличию карбоксильных групп лимонная кислота способна образовывать прочные водородные связи.
Рисунок 02: Химическая структура лимонной кислоты
Лимонная кислота — это трехосновная кислота. Он может выделять три протона (H + ) на молекулу. Следовательно, он имеет три значения pKa. pK a1 равно 3.13, pK a2 составляет 4,76, а pK a3 составляет 6,40. Биологическая роль лимонной кислоты — это цикл лимонной кислоты; основной путь метаболизма животных и растений.
Применение лимонной кислоты
- Используется как пищевая добавка
- Используется как напиток
- Действовать как хелатирующий агент
- Состав косметики
Рис. 03: Лимонная кислота используется при приготовлении еды и напитков
03: Лимонная кислота используется при приготовлении еды и напитков
Сходства между уксусной кислотой и лимонной кислотой
- Уксусная кислота и лимонная кислота — слабые кислоты.
- Часто используются в качестве пищевых добавок.
Разница между уксусной кислотой и лимонной кислотой
Определение
Уксусная кислота: Уксусная кислота — полезная слабая кислота, которая содержится в основном в уксусе.
Лимонная Кислота: Лимонная кислота — это слабая кислота, содержащаяся в цитрусовых.
Кислотность
Уксусная кислота: Уксусная кислота одноосновная (имеет один замещаемый атом водорода).
Лимонная Кислота: Лимонная кислота трехосновная (имеет три заменяемых атома водорода).
Молярная масса
Уксусная кислота: Молярная масса уксусной кислоты составляет около 60 г / моль.
Лимонная Кислота: Молярная масса лимонной кислоты составляет около 192 г / моль.
Химическая формула
Уксусная кислота: Химическая формула уксусной кислоты: CH 3 COOH.
Лимонная Кислота: Химическая формула лимонной кислоты: C 3 H 5 O (COOH) 3 .
Число групп карбоновых кислот
Уксусная кислота: Уксусная кислота имеет только одну группу карбоновой кислоты.
Лимонная Кислота: Лимонная кислота имеет три группы карбоновых кислот.
Температура кипения
Уксусная кислота: Температура кипения уксусной кислоты составляет около 118 o ° C.
Лимонная Кислота: Температура кипения лимонной кислоты составляет примерно 310 o C.
pK
a
Уксусная кислота: Уксусная кислота имеет только одно значение pK a .
Лимонная Кислота: Лимонная кислота имеет три значения pK и .
Заключение
И уксусная, и лимонная кислоты являются очень полезными кислотными соединениями. Эти соединения вносят значительный вклад в небольшие приложения, а также в крупномасштабные отрасли промышленности. Основное различие между уксусной кислотой и лимонной кислотой заключается в том, что уксусная кислота является одноосновной кислотой, тогда как лимонная кислота является трехосновной кислотой.
Артикул:
1. ”Уксусная кислота (Ch4COOH).Британская энциклопедия. Encyclopdia Britannica, inc., N.d. Интернет. Доступно здесь. 03 июля 2017 г.
2. «Что такое уксусная кислота». Study.com. Study.com, n.d. Интернет. Доступно здесь. 03 июля 2017.
Изображение предоставлено:
1. «Уксусная кислота-2D-плоский» Автор NEUROtiker — собственная работа (общественное достояние) через Commons Wikimedia
«Уксусная кислота-2D-плоский» Автор NEUROtiker — собственная работа (общественное достояние) через Commons Wikimedia
2. «Zitronensäure — лимонная кислота» Benjah-bmm27 — собственная работа (общественное достояние) через Commons Wikimedia
3. «Апельсины и апельсиновый сок», фото Скотта Бауэра, Министерство сельского хозяйства США. Номер изображения K7237-8.(Общественное достояние) через Commons Wikimedia
редокс — уксус (уксус) и лимонная кислота в качестве средства для удаления ржавчины
Давным-давно я работал над составом средств для удаления ржавчины для железа. Нам нужно было позаботиться о токсичности, коррозии, стоимости, удалении отходов, эффективности, скорости, повреждении (не корродированного) металла и мгновенной коррозии (быстрое ржавление после смывания очистителя).
Ржавчина — это не просто химическое соединение. Обычно это гидраты $ \ ce {FeO} $ и $ \ ce {Fe2O3} $ (а их очень много, даже если исключить гидроксиды).
Итак, поскольку разные кислоты по-разному влияют на разные химические вещества, вам не обязательно найти одну волшебную пулю для любого типа ржавчины. Чем сильнее кислота, тем больше металл подвергнется атаке, если не используется пассивация (есть два типа химической и электрической). Также часто используются амины. Сильные кислоты Соляная, серная, азотная более агрессивны, чем более слабые органические кислоты. В Naval Jelly (с которым я работал) используется фосфорная кислота, но, как вы заметили, она покрывает сталь / железо.Эти минеральные кислоты могут быть опасными, и их нельзя просто выбросить после еды.
Чем сильнее кислота, тем больше металл подвергнется атаке, если не используется пассивация (есть два типа химической и электрической). Также часто используются амины. Сильные кислоты Соляная, серная, азотная более агрессивны, чем более слабые органические кислоты. В Naval Jelly (с которым я работал) используется фосфорная кислота, но, как вы заметили, она покрывает сталь / железо.Эти минеральные кислоты могут быть опасными, и их нельзя просто выбросить после еды.
Есть альтернативы. Один из приемов состоит в том, чтобы превратить хлорид, сульфат или нитрат в раствор, используя соединение, отличное от кислоты. Например, добавление хлорида натрия к раствору лимонной кислоты должно сделать лимонную кислоту более агрессивной, но при этом не изменит pH. (Одна из причин этого состоит в том, что $ \ ce {FeCl3} $ более растворим, чем цитрат железа.)
В некоторых антиобледенителях используется нитрат или хлорид кальция, которые также могут быть эффективными, и, конечно же, в некоторых удобрениях также используются нитраты (даже некоторые для комнатных растений). Итак, если вы не хотите работать с сильными кислотами (если вы не осторожный человек, вам не следует работать с ними), вы можете попробовать этот подход.
Итак, если вы не хотите работать с сильными кислотами (если вы не осторожный человек, вам не следует работать с ними), вы можете попробовать этот подход.
Насколько мне известно, единственная другая кислота, обычно используемая для удаления ржавчины, — это щавелевая кислота. Я думаю, что очищающее средство Зуд использует его, если вы его найдете. Это яд, поэтому не облизывайте пальцы, пока не вымоете их (да, даже если вы НАДЕЕТЕ перчатки!). Не думаю, что это намного лучше, чем лимонная кислота. На самом деле, я бы предположил, что с точки зрения удаления ржавчины это хуже.
Азотную кислоту, вероятно, будет сложно найти / купить. Соляная кислота доступна (в последний раз я смотрел) в Home Depot ect. (Ищите чистящие средства, средства для чистки канализации и средства для чистки цемента). Серная кислота тоже. Он также используется в качестве аккумуляторной кислоты, но я не уверен, можно ли купить его в магазине автозапчастей без свинца. Делайте , а не , покупайте что-нибудь со свинцом! Не используйте ничего (например, старую аккумуляторную кислоту) со свинцом (Pb) в нем. Не трогайте … вы поняли, правда? Наконец, посмотрите на таблицу значений pKa для кислот.
Не трогайте … вы поняли, правда? Наконец, посмотрите на таблицу значений pKa для кислот.
Единственными другими ионами, с которыми я мог бы дурачиться, были бы йодид и бромид и, возможно, фторид, только для усмешек и хихиканья. Понятия не имею, где их взять. (некоторые чистящие средства для алюминия (алюминиевое желе?) содержат фториды). Подсказка: одна из причин, по которой лимонная кислота работает очень хорошо, заключается в том, что образующаяся ею соль более растворима, чем что-то вроде фосфата железа, поэтому она покидает поверхность, позволяя дальнейшее воздействие.
Итак, эффективность будет зависеть не только от силы кислоты, но и от растворимости солей железа.В идеале вы хотите избегать любой окисляющей кислоты (поскольку она растворяет (окисляет) металл), но на самом деле небольшая потеря металла помогает избавиться от этой устойчиво цепляющейся ржавчины.
Специализированный цикл лимонной кислоты, требующий сукцинил-коэнзима A (CoA): ацетат-CoA-трансфераза (AarC) придает ацидофилу устойчивость к уксусной кислоте Acetobacter aceti
Бактерии уксусной кислоты (AAB) — это грамотрицательные, ацидофильные окисляющие α-протеобактерии. этанол в уксусную кислоту с использованием ферментов мембраносвязанной алкогольдегидрогеназы (ADH) и альдегиддегидрогеназы.AAB чрезвычайно устойчивы к проницаемым для мембран токсичным соединениям этанолу и уксусной кислоте при низком pH. Представители AAB рода Acetobacter исторически отличались от представителей рода Gluconobacter по предпочтению этанола и способности «сверхокислять» ацетат до CO 2 , обычно, когда этанол недоступен (5). Окисление ацетата подразумевает окислительное декарбоксилирование, осуществляемое дегидрогеназами цикла лимонной кислоты (САС) и полным САС.
этанол в уксусную кислоту с использованием ферментов мембраносвязанной алкогольдегидрогеназы (ADH) и альдегиддегидрогеназы.AAB чрезвычайно устойчивы к проницаемым для мембран токсичным соединениям этанолу и уксусной кислоте при низком pH. Представители AAB рода Acetobacter исторически отличались от представителей рода Gluconobacter по предпочтению этанола и способности «сверхокислять» ацетат до CO 2 , обычно, когда этанол недоступен (5). Окисление ацетата подразумевает окислительное декарбоксилирование, осуществляемое дегидрогеназами цикла лимонной кислоты (САС) и полным САС.
Молекулярные механизмы устойчивости к уксусной кислоте у Acetobacter aceti включают адаптацию цитоплазматических компонентов (9, 14) к внутреннему подкислению (32), отток уксусной кислоты через уксусную кислоту AatA: протонный антипортер (31, 39) и производство кислотно-индуцируемых белков, идентифицированных протеомными скринами, многие из которых имеют неопределенную биохимическую роль (28, 52).
A. aceti , штамм 1023, особенно кислотоустойчивый и сравнительно термотолерантный заводской изолят уксуса (41, 42), требует генов устойчивости к уксусной кислоте aarABC для роста на> 50 мМ уксусной кислоте при низком pH (16).AarA — гексамерная форма цитрат-синтазы, нечувствительная к НАДН (15). Предполагается, что AarB будет основным белком из 154 аминокислот без гомологов или известной функции (16). AarC необходим для окисления ацетата и напоминает несколько трансфераз ацил-кофермент A (CoA): карбоксилат-CoA, но не является ацетил-CoA синтетазой (17).
Очевидное требование A. aceti CAC для устойчивости к уксусной кислоте может указывать на прямую роль в истощении цитоплазматического ацетата путем окисления ацетил-КоА до CO 2 или на общий вклад в производство энергии. A. aceti требует интенсивной оксигенации при высоких уровнях ацетата и низких значениях pH (37), что согласуется с любой ролью CAC. Однако черновая последовательность генома A. aceti штамма 1023 (T. J. Kappock, S. W. Clifton и R. K. Wilson, неопубликованные данные) не содержит генов малатдегидрогеназы (Mdh) и сукцинил-CoA-синтетазы (SCS).
aceti штамма 1023 (T. J. Kappock, S. W. Clifton и R. K. Wilson, неопубликованные данные) не содержит генов малатдегидрогеназы (Mdh) и сукцинил-CoA-синтетазы (SCS).
Целью этого исследования было выяснить, прерывается ли A. aceti CAC. Мы обнаружили, что A. aceti содержит полный, но модифицированный САС, позволяющий прямое включение ацетата с помощью внутреннего шунта.Mdh и SCS функционально замещены малат: хинон оксидоредуктазой (Mqo) и сукцинил-КоА: ацетат-КоА-трансферазой (SCACT), соответственно. SCACT кодируется aarC . Эта биохимическая функция объясняет генетические доказательства важной роли aarC в устойчивости, ассимиляции и окислении уксусной кислоты (16, 17).
МАТЕРИАЛЫ И МЕТОДЫ
Реактивы и общие аналитические методы. Химические вещества были приобретены у Sigma-Aldrich (Сент-Луис, Миссури) или Fisher (Хьюстон, Техас).Детиацетил-КоА синтезировали, как описано ранее (15). Олигодезоксинуклеотидные праймеры были получены от Integrated DNA Technologies (Coralville, IA) и использованы без дополнительной очистки. Цитрат-синтаза A. aceti с гексагистидиновой аффинной меткой (CSH6 Aa ) была очищена, как описано ранее (15). Рестрикционные ферменты, ДНК-модифицирующие ферменты и стандарты размера ДНК были приобретены в New England Biolabs (Beverly, MA). Измерения оптической плотности регистрировали на спектрофотометре Cary Bio 100 UV-visible (Varian, Пало-Альто, Калифорния) или спектрофотометре с диодной матрицей (Agilent Technologies, Санта-Клара, Калифорния).Аналитическая гель-фильтрация, масс-спектрометрия с ионизацией электрораспылением (ESI-MS) и количественный анализ белка по методу Брэдфорда выполнялись, как описано ранее (14).
Цитрат-синтаза A. aceti с гексагистидиновой аффинной меткой (CSH6 Aa ) была очищена, как описано ранее (15). Рестрикционные ферменты, ДНК-модифицирующие ферменты и стандарты размера ДНК были приобретены в New England Biolabs (Beverly, MA). Измерения оптической плотности регистрировали на спектрофотометре Cary Bio 100 UV-visible (Varian, Пало-Альто, Калифорния) или спектрофотометре с диодной матрицей (Agilent Technologies, Санта-Клара, Калифорния).Аналитическая гель-фильтрация, масс-спектрометрия с ионизацией электрораспылением (ESI-MS) и количественный анализ белка по методу Брэдфорда выполнялись, как описано ранее (14).
Бактериальные штаммы, среды и плазмиды. Штаммы бактерий и плазмиды, использованные в этом исследовании, перечислены в таблице 1. Штаммы A. aceti размножали в среде дрожжевой экстракт-пептон-декстроза Difco (Becton Dickinson, Franklin Lakes, NJ ) с добавлением 2,5% этанола при 30 ° C, как описано ранее (14).ДНК выделяли и обрабатывали с использованием стандартных протоколов (2). ПЦР выполняли с использованием геномной ДНК A. aceti (выделенной ДНКзолом; Центр молекулярных исследований, Цинциннати, Огайо), подходящих олигодезоксинуклеотидных праймеров и ДНК-полимеразы Вента (New England Biolabs). Все клоны содержали ожидаемые последовательности ДНК.
ПЦР выполняли с использованием геномной ДНК A. aceti (выделенной ДНКзолом; Центр молекулярных исследований, Цинциннати, Огайо), подходящих олигодезоксинуклеотидных праймеров и ДНК-полимеразы Вента (New England Biolabs). Все клоны содержали ожидаемые последовательности ДНК.
ТАБЛИЦА 1.
Бактериальные штаммы и плазмиды, использованные в этом исследовании
ВЭЖХ-связанные анализы SCACT. Анализы SCACT проводили при 25 ° C в 50 мМ фосфате калия (pH 8.0), 100 мМ KCl, указанные субстраты и AarC с С-концевым гексагистидин-содержащим гибридным пептидом (AarCH6; от 5 до 50 нг), который использовали для инициации реакции. Реакционные смеси прямого направления (анализ LCF) содержат 350 мМ ацетата калия, 0,2 мМ сукцинил-КоА или различные количества одного субстрата. Реакционные смеси обратного направления (LCR-анализы) содержали 20 мМ янтарной кислоты, 1 мМ ацетил-КоА или различные количества одного субстрата. Через 5 мин аликвоту (0,1 мл) реакционной смеси переносили в 6.25% трихлоруксусной кислоты (0,4 мл), кратковременно встряхивают и центрифугируют при 16,100 × г в течение 3 мин. Затем растворимую часть переносили во флакон с автоматическим пробоотборником и анализировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием метода, описанного в дополнительном материале. Таким же образом обрабатывали контроли без ферментов.
Затем растворимую часть переносили во флакон с автоматическим пробоотборником и анализировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием метода, описанного в дополнительном материале. Таким же образом обрабатывали контроли без ферментов.
Площади пиков соотносили с калибровочной кривой ацетил-КоА (ε 260 нм = 16,4 мМ -1 см -1 ) (12), а скорости определяли по площади пика продукта тиоэфира КоА.В условиях фиксированного времени анализа скорость образования продукта была линейной в каждом направлении в течение не менее 10 мин. Скорости представляли собой средние значения трех или четырех определений, если не указано иное. Кинетические константы определяли с помощью Prism (GraphPad) для соответствия уравнениям кинетики Михаэлиса-Ментен, конкурентного ингибирования или ингибирования субстратом (8). Тест суммы квадратов F был использован для различения альтернативных кинетических моделей.
Эксперименты по инактивации. AarCH6 (0,5 мкг) инкубировали 10 мин при 25 ° C в 0,5 мл смеси, содержащей 50 мМ фосфата калия (pH 8,0), 100 мМ KCl и 100 мкМ ацетил-КоА. Боргидрид натрия добавляли до 10 мМ с последующей инкубацией в течение дополнительных 10 минут. Затем сразу же добавляли аликвоту (5 мкл) раствора фермента к полному анализу LCR для измерения остаточной ферментативной активности. В контрольных реакциях отсутствовали борогидрид натрия, ацетил-КоА или то и другое. Остаток обработанного белкового раствора мгновенно замораживали и позже анализировали с помощью ESI-MS.
AarCH6 (0,5 мкг) инкубировали 10 мин при 25 ° C в 0,5 мл смеси, содержащей 50 мМ фосфата калия (pH 8,0), 100 мМ KCl и 100 мкМ ацетил-КоА. Боргидрид натрия добавляли до 10 мМ с последующей инкубацией в течение дополнительных 10 минут. Затем сразу же добавляли аликвоту (5 мкл) раствора фермента к полному анализу LCR для измерения остаточной ферментативной активности. В контрольных реакциях отсутствовали борогидрид натрия, ацетил-КоА или то и другое. Остаток обработанного белкового раствора мгновенно замораживали и позже анализировали с помощью ESI-MS.
Номера доступа нуклеотидных последовательностей. Последовательности, представленные в этой статье, имеют следующие номера доступа GenBank: uctA , DQ668371; uctB — oxc — uctC — duf1275 , DQ668372; uctD , DQ668373; aarA — sixA — tyrA — orf1 — aarC , DQ631551; и mqo , DQ674275.
РЕЗУЛЬТАТЫ
Предполагаемые метаболические судьбы ацетата. Черновик 3-Mb A.Последовательность генома штамма 1023 aceti , проанализированная, как описано в дополнительном материале, содержит все гены, необходимые для шести из восьми ферментов канонической САС. Гены SCS, Mdh или ферментов глиоксилатного шунта не идентифицированы. Присутствует связанный с мембраной Mqo, замена Mdh у различных бактерий (18, 36). Также присутствуют ферменты, необходимые для преобразования ацетата в ацетил-КоА, позволяющие удалять ацетат с помощью САС: ацетил-КоА-синтетаза (Acs) или ацетаткиназа (AckA) и фосфотрансацетилаза (Pta).
Черновик 3-Mb A.Последовательность генома штамма 1023 aceti , проанализированная, как описано в дополнительном материале, содержит все гены, необходимые для шести из восьми ферментов канонической САС. Гены SCS, Mdh или ферментов глиоксилатного шунта не идентифицированы. Присутствует связанный с мембраной Mqo, замена Mdh у различных бактерий (18, 36). Также присутствуют ферменты, необходимые для преобразования ацетата в ацетил-КоА, позволяющие удалять ацетат с помощью САС: ацетил-КоА-синтетаза (Acs) или ацетаткиназа (AckA) и фосфотрансацетилаза (Pta).
Последовательность генома содержит пять CoA-трансфераз, четыре с неназначенными функциями (от uctA до uctD ) и aarC . Новая последовательность aarC кодирует белок из 505 аминокислот с предсказанной изоэлектрической точкой 6,16. Первоначально сообщенный ген aarC (номер доступа в GenBank D13291) имеет 496 аминокислот и другую последовательность в остатках с 1 по 40 (новые остатки AarC с 1 по 54) (16). Единственное отличие последовательности кодирующей области — это вставка G после нуклеотида 178 в исходном отчете о последовательности (G210 в измененной последовательности).
Единственное отличие последовательности кодирующей области — это вставка G после нуклеотида 178 в исходном отчете о последовательности (G210 в измененной последовательности).
Повторная аннотация гена в области aarB . Условно незаменимые гены устойчивости к уксусной кислоте были идентифицированы в мутантных штаммах A. aceti 1023, которые не выдерживали воздействия 50 мМ уксусной кислоты при низком pH, но которые могли расти при эквивалентный pH, создаваемый непроницаемой для мембран минеральной кислотой HCl (16). Эксперименты по инсерционной инактивации были использованы для определения гена aarABC и, по-видимому, существенного гена X (рис. 1) (4).
РИС. 1.
Пересмотренная аннотация области aar в штамме A. aceti 1023. Открытые рамки считывания из исходного назначения гена (вверху) были назначены с использованием инактивации инсерционной кассеты канамицина в сайтах рестрикции, указанных вертикальными треугольниками (16). Точки введения были охарактеризованы как устойчивые к 50 мМ уксусной кислоте (незакрашенные треугольники), чувствительные (закрашенные треугольники) или явно необходимые (заштрихованные треугольники). Первоначально назначенные функции были следующими: aarA , цитрат-синтаза; aarB , неизвестно; X, неизвестно; и aarC , возможная CoA-трансфераза или -гидролаза.На момент написания ни aarB, , ни X не имели значительного сходства с другими предполагаемыми белковыми последовательностями. К новым назначенным функциям относятся следующие: или , предполагаемая металлофосфоэстераза; tyrA , хоризматмутаза; и sixA , фосфопротеинфосфатаза, которая влияет на двухкомпонентный регулятор ArcA / ArcB. Пересмотренные назначения включают вставку одного основания в область aarC , которая немного удлиняет ORF. Вставка в сайт NsiI, которая не нарушает устойчивости к уксусной кислоте, нарушила бы продукт гена aarB после Ala19 или удаляла бы или изменила семь или меньше C-концевых аминокислот в SixA.
Точки введения были охарактеризованы как устойчивые к 50 мМ уксусной кислоте (незакрашенные треугольники), чувствительные (закрашенные треугольники) или явно необходимые (заштрихованные треугольники). Первоначально назначенные функции были следующими: aarA , цитрат-синтаза; aarB , неизвестно; X, неизвестно; и aarC , возможная CoA-трансфераза или -гидролаза.На момент написания ни aarB, , ни X не имели значительного сходства с другими предполагаемыми белковыми последовательностями. К новым назначенным функциям относятся следующие: или , предполагаемая металлофосфоэстераза; tyrA , хоризматмутаза; и sixA , фосфопротеинфосфатаза, которая влияет на двухкомпонентный регулятор ArcA / ArcB. Пересмотренные назначения включают вставку одного основания в область aarC , которая немного удлиняет ORF. Вставка в сайт NsiI, которая не нарушает устойчивости к уксусной кислоте, нарушила бы продукт гена aarB после Ala19 или удаляла бы или изменила семь или меньше C-концевых аминокислот в SixA. Масштабная линейка представлена в единицах bp.
Масштабная линейка представлена в единицах bp.
Новые аннотации генов предсказывают три открытые рамки считывания (ORF) на противоположной цепи: orf1 , кодирующую предполагаемую металлофосфоэстеразу; tyrA , кодирующий хоризматмутазу; и sixA , кодирующий регулятор транскрипции, вовлеченный в систему ретрансляции фосфогистидина. Синтения генов в четырех доступных геномах AAB подтверждает новые назначения (19, 45; Kappock et al., Неопубликовано; http://genome.jgi-psf.org/finished_microbes/acicr/acicr.home.html
). AAB имеет колинеарное расположение orf1 — sixA — gltA ( gltA , цитрат-синтаза, эквивалент A. aceti aarA ), за исключением Acidiphilium cryptum , который имеет предполагаемую фосфатазу или находится в другом месте. В A. aceti и Gluconobacter oxydans , tyrA вставлен между orf1 и sixA , а Granulibacter bethesdensis имеет два гена, вставленных между sixA и gltA.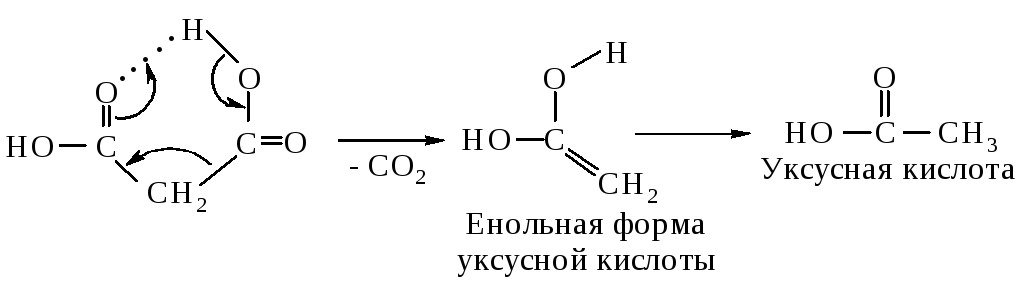 В пересмотренном назначении aarC дивергентно транскрибируется от всех других генов в области гена aar . Транскрипционный анализ генов aar продолжается.
В пересмотренном назначении aarC дивергентно транскрибируется от всех других генов в области гена aar . Транскрипционный анализ генов aar продолжается.
Анализы активности ферментов. Как и ожидалось из данных о последовательности генома, шесть из восьми канонических активностей ферментов САС были обнаружены в лизатах клеток A. aceti (таблица 2). Не было обнаружено активности ферментов глиоксилатного шунта изоцитратлиазы и малатсинтазы (данные не показаны), SCS или Mdh, но активности SCACT и Mqo обнаружены.Активность SCACT была первоначально обнаружена как сукцинат-зависимое разложение ацетил-КоА с использованием варианта анализа VisR, который описан в дополнительном материале. Сукцинат был единственной из 15 карбоновых кислот, поддерживающих активность.
ТАБЛИЦА 2.
Активность ферментов в штаммах A. aceti
Ранее опубликованные анализы CoA-трансферазы с использованием цитрат-синтазы для количественного определения ацетил-CoA не подходили для кинетической характеристики. Прерывистые методы VisF / VisR, описанные в дополнительном материале, были разработаны для использования со сложными клеточными лизатами.Анализы LCF и LCR на основе ВЭЖХ использовались для количественного определения индивидуальных (ацил-) CoA, что позволяло различать активности ацил-CoA гидролазы и трансферазы. Были идентифицированы условия гашения реакции, которые сводили к минимуму, но не исключали разложение ацил-КоА в течение нескольких часов. Повторные эксперименты были выполнены таким образом, что средняя скорость при каждой концентрации определялась с той же средней задержкой. Поправки на скорость, основанные на наблюдаемых скоростях разложения ацил-КоА, увеличат зарегистрированное значение k
Прерывистые методы VisF / VisR, описанные в дополнительном материале, были разработаны для использования со сложными клеточными лизатами.Анализы LCF и LCR на основе ВЭЖХ использовались для количественного определения индивидуальных (ацил-) CoA, что позволяло различать активности ацил-CoA гидролазы и трансферазы. Были идентифицированы условия гашения реакции, которые сводили к минимуму, но не исключали разложение ацил-КоА в течение нескольких часов. Повторные эксперименты были выполнены таким образом, что средняя скорость при каждой концентрации определялась с той же средней задержкой. Поправки на скорость, основанные на наблюдаемых скоростях разложения ацил-КоА, увеличат зарегистрированное значение k
cat менее чем на 16%.
Скрининг экспрессии и активности гена-кандидата SCACT. Гены-кандидаты от uctA до uctD и aarC были сверхэкспрессированы в виде растворимых белков в Escherichia coli (рис. 2). Только клетки, продуцирующие UctD или AarC, имели активность выше, чем у векторного контроля (анализ VisR). Удельная активность SCACT была намного выше в лизате клеток, экспрессирующих aarC , даже несмотря на то, что AarC был наименее растворимым из пяти CoA-трансфераз.Таким образом, SCACT, по-видимому, продуцируется исключительно из гена aarC . Мы планируем изучить штаммы , дефицитные по aarC , чтобы подтвердить, что A. aceti содержит только один ген SCACT.
Удельная активность SCACT была намного выше в лизате клеток, экспрессирующих aarC , даже несмотря на то, что AarC был наименее растворимым из пяти CoA-трансфераз.Таким образом, SCACT, по-видимому, продуцируется исключительно из гена aarC . Мы планируем изучить штаммы , дефицитные по aarC , чтобы подтвердить, что A. aceti содержит только один ген SCACT.
РИС. 2.
Экспрессия генов-кандидатов SCACT в штамме E. coli C41 (DE3). Левые дорожки, очищенные клеточные лизаты (центрифугирование при 16000 × g в течение 10 минут) для штаммов, продуцирующих A. aceti CoA-трансферазу, анализировали на способность потреблять ацетил-КоА (анализ VisR) и анализировали с помощью додецилсульфата натрия. -электрофорез в полиакриламидном геле.Относительная активность каждого белка в том же объеме культуры выражается в процентах от активности AarC (только векторный контрольный лизат имеет относительную активность 0,008%): UctA (дорожка 1, ожидаемая 41,5 кДа; 0,007%), UctB (дорожка 2, ожидаемое значение 47,6 кДа; 0,01%), UctC (дорожка 3, ожидаемое значение 41,8 кДа; 0,01%), UctD (дорожка 4, ожидаемое значение 55,5 кДа; 0,3%) и AarC (дорожка 5, ожидаемое значение 54,8 кДа; 100%).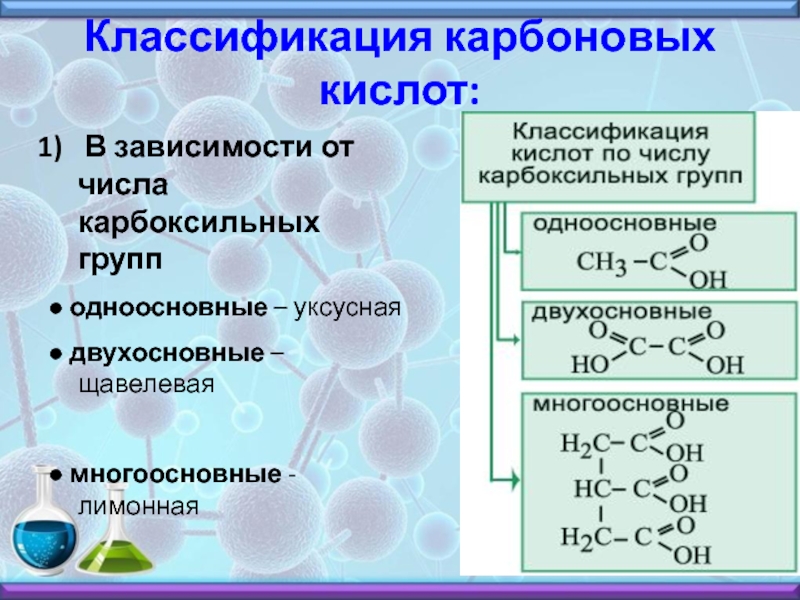 Дорожка 6 показывает сравнимое количество общего клеточного белка для клеток, продуцирующих AarC, демонстрируя ограниченную растворимость этого белка.Параллельный эксперимент с клетками, продуцирующими AarCH6 (не показаны), показал относительную активность 74%, но также и более низкую долю растворимого белка, чем клетки, продуцирующие AarC. Правая полоса, очищенный AarCH6 (полоса 7; 5 мкг белка). Указаны стандартные позиции размеров.
Дорожка 6 показывает сравнимое количество общего клеточного белка для клеток, продуцирующих AarC, демонстрируя ограниченную растворимость этого белка.Параллельный эксперимент с клетками, продуцирующими AarCH6 (не показаны), показал относительную активность 74%, но также и более низкую долю растворимого белка, чем клетки, продуцирующие AarC. Правая полоса, очищенный AarCH6 (полоса 7; 5 мкг белка). Указаны стандартные позиции размеров.
AarC с С-концевым слитым пептидом, содержащим гексагистидин (AarCH6), обильно продуцировался при 15 ° C, но оказался немного менее растворимым, чем непомеченный белок (данные не показаны). Осветленные лизаты клеток E. coli , продуцирующих AarCH6, обладали почти такой же активностью, как и лизаты, продуцирующие AarC, что указывает на то, что С-концевой слитый пептид не оказывает значительного ингибирования ферментативной активности.
Очистка и свойства AarCH6.AarCH6 очищали с использованием процедуры фракционирования сульфатом аммония, ранее разработанной для немаркированного AarC, и стадии сродства с иммобилизованным металлом, которые описаны в дополнительном материале. 8-литровая культура pJK385 / C41 (DE3) дала 9,5 мг очищенного AarCH6 (рис. 2).
8-литровая культура pJK385 / C41 (DE3) дала 9,5 мг очищенного AarCH6 (рис. 2).
Анализ ESI-MS показал, что AarCH6 представляет собой белок с 513 остатками, лишенный Met1 (наблюдается 55 847 ± 2 Да; ожидается 55 847,2 Да). Аналитическая гель-фильтрация дала единственный пик с молекулярной массой 160 кДа, соответствующий состоянию раствора тримерного или удлиненного димера.
Флуоресцентное излучение AarCH6 показало максимум при 343 нм, который был погашен на 8% добавлением детиацетил-КоА, негидролизуемого аналога ацетил-КоА, который имеет метиленовую группу, замещающую атом серы (30). Флуоресцентное титрование, проведенное, как описано в дополнительном материале, использовали для определения кажущейся K d (константа диссоциации) (таблица 3). Не было отмечено изменений флуоресценции при добавлении 10 мМ сукцината к раствору, содержащему 1 мкМ AarCH6 и 10 мкМ детиацетил-КоА.
ТАБЛИЦА 3.
Кинетические константы для AarCH6 a
Механизм AarC. AarC, по прогнозам, является CoA-трансферазой класса I по результатам выравнивания последовательностей активных сайтов, которые идентифицируют Glu435 как ключевой остаток активного сайта (29). КоА-трансферазы класса I сначала связывают субстрат ацил-КоА, образуя карбоксилатный продукт и промежуточный продукт фермент-КоА-тиоэфир (48, 50), что объясняет наблюдаемую кинетику пинг-понга (22) и чувствительность к инактивации борогидрида (23, с. 25, 50).Обработка AarCH6 борогидридом натрия в присутствии ацетил-КоА вызвала почти полную потерю активности фермента (относительная активность 0,7%), что согласуется с восстановлением промежуточного тиоэфира глутамил-КоА до 5-гидроксинорвалина. Анализ ESI-MS ферментного комплекса, обработанного борогидридом, показал ожидаемое изменение на -14 Да (наблюдаемое 55 832 ± 2 Да; ожидаемое 55 833,2). AarCH6, обработанный боргидридом в отсутствие субстрата ацил-КоА, показал частичную инактивацию (активность 71%) по сравнению с контролем, в котором отсутствовали как ацетил-КоА, так и боргидрид натрия (активность 100%; 74 с -1 ).
AarC, по прогнозам, является CoA-трансферазой класса I по результатам выравнивания последовательностей активных сайтов, которые идентифицируют Glu435 как ключевой остаток активного сайта (29). КоА-трансферазы класса I сначала связывают субстрат ацил-КоА, образуя карбоксилатный продукт и промежуточный продукт фермент-КоА-тиоэфир (48, 50), что объясняет наблюдаемую кинетику пинг-понга (22) и чувствительность к инактивации борогидрида (23, с. 25, 50).Обработка AarCH6 борогидридом натрия в присутствии ацетил-КоА вызвала почти полную потерю активности фермента (относительная активность 0,7%), что согласуется с восстановлением промежуточного тиоэфира глутамил-КоА до 5-гидроксинорвалина. Анализ ESI-MS ферментного комплекса, обработанного борогидридом, показал ожидаемое изменение на -14 Да (наблюдаемое 55 832 ± 2 Да; ожидаемое 55 833,2). AarCH6, обработанный боргидридом в отсутствие субстрата ацил-КоА, показал частичную инактивацию (активность 71%) по сравнению с контролем, в котором отсутствовали как ацетил-КоА, так и боргидрид натрия (активность 100%; 74 с -1 ). Частичная инактивация может указывать на то, что часть фермента выделена в виде аддукта AarCH6-CoA.
Частичная инактивация может указывать на то, что часть фермента выделена в виде аддукта AarCH6-CoA.
Эксперименты в стационарном состоянии с дублированием анализов LCR показали непересекающиеся линии на графиках с двойной обратной связью, что соответствует кинетике пинг-понга и механизму модифицированного фермента (см. Рисунок S2 в дополнительном материале).
Кинетическая характеристика AarCH6. Определение точных кинетических параметров AarCH6 осложнялось очевидным ингибированием ацетатным субстратом (рис.3А) и присутствие КоА, обычного загрязнителя в коммерческих ацил-КоА (~ 5% в ацетил-КоА, ~ 11% в сукцинил-КоА), что препятствует насыщению субстрата. Точные кинетические константы кислотного субстрата для CoA-трансфераз класса I требуют насыщения фермента субстратом ацил-CoA. Анализы LCF / LCR позволяли одновременно определять уровни КоА и ферментативную активность. Сходные кинетические параметры были получены с использованием анализов LCF / LCR и VisF / VisR (фиг. 3A).
РИС. 3.
Кинетическая характеристика AarCH6.(A) Данные насыщения ацетатом при pH 8,0 (закрашенные кружки, анализ LCF; незакрашенные ромбики, анализ VisF) и pH 5,0 (сплошные квадраты, анализ LCF; крестики, анализ VisF). Сплошные линии соответствуют каждому набору данных LCF, предполагая ингибирование субстратом. Концентрация сукцинил-КоА составляла 0,2 мМ. Соответствующие параметры приведены в тексте и в таблице 3. (B) Данные насыщения ацетил-КоА при pH 8,0, полученные с помощью анализа LCR (закрашенные кружки) при 20 мМ сукцинате. Сплошная линия соответствует данным, учитывающим конкурентное ингибирование из-за КоА (определено в анализируемых смесях с добавлением КоА).Пунктирная линия представляет собой моделирование с использованием подобранных параметров при концентрации CoA 0,
Кинетический анализ был выполнен для каждого субстрата при единственной насыщающей, но минимально ингибирующей концентрации второго субстрата. Анализы LCR с добавлением КоА показали, что КоА является эффективным конкурентным ингибитором по сравнению с ацетил-КоА. График зависимости скорости от концентрации ацетил-КоА удовлетворительно подходит только в том случае, если принимать во внимание ингибирование из-за остаточного КоА (рис. 3В). Увеличенный разброс скоростей, определенный с помощью сукцинил-КоА (анализ LCF), дал совпадения, которые не были улучшены поправкой на ингибирование КоА.Если КоА является одинаково мощным конкурентом для каждого субстрата ацил-КоА, приведенные значения занижают сукцинил-КоА K m и k
График зависимости скорости от концентрации ацетил-КоА удовлетворительно подходит только в том случае, если принимать во внимание ингибирование из-за остаточного КоА (рис. 3В). Увеличенный разброс скоростей, определенный с помощью сукцинил-КоА (анализ LCF), дал совпадения, которые не были улучшены поправкой на ингибирование КоА.Если КоА является одинаково мощным конкурентом для каждого субстрата ацил-КоА, приведенные значения занижают сукцинил-КоА K m и k
cat значения на ∼15%, но оказывают незначительное влияние на K
экв (константа равновесия). Неингибированные кинетические константы, полученные с помощью индивидуального анализа субстрата (таблица 3), разумно согласуются со значениями, полученными с помощью предварительного двойного реципрокного анализа (данные не показаны).
Ацетоацетат является косубстратом для нескольких КоА-трансфераз, которые превращают сукцинил-КоА в сукцинат (10, 24).Анализы LCF, содержащие ацетоацетат вместо ацетата, показали образование ацетоацетил-CoA, идентифицированного путем сравнения со временем удерживания ВЭЖХ аутентичного стандарта. Модель k
Модель k
cat / K m для ацетоацетата составляло 7% от этого показателя для ацетата при тех же условиях (Таблица 3).
Зависимость кинетических параметров ацетата от pH. Ожидается, что ацетат будет истинным субстратом для SCACT. Его мольная доля должна уменьшаться при падении pH ниже pK a уксусной кислоты, 4.76. Кинетические параметры определяли с помощью анализа LCF при pH 8,0 (таблица 3), pH 6,0 ( k
кот = 147 с −1 ; K м = 51 ± 11 мМ; K i = 1100 ± 310 мМ) и pH 5,0 ( k
cat = 49 с −1 ; K м = 29 ± 8 мМ; K i = 500 ± 130 мМ). Повышенное ингибирование субстрата при более низком pH может быть связано с увеличением доли уксусной кислоты (рис.3А). Скорости LCF и VisF были сопоставимы при всех испытанных значениях pH.
ОБСУЖДЕНИЕ
Генетический скрининг выявил две категории генов Acetobacter , влияющих на устойчивость к уксусной кислоте: (i) те, которые улучшают устойчивость к уксусной кислоте штаммов A. aceti при введении или сверхэкспрессии, включая кластер генов aarABC (16) и ген аконитазы (38), и (ii) те, которые улучшают устойчивость к уксусной кислоте E. coli , включая гены RecG (51) и AatA (39).Настоящее исследование было разработано для оценки потенциальной роли CAC и связанных путей в удалении уксусной кислоты.
aceti при введении или сверхэкспрессии, включая кластер генов aarABC (16) и ген аконитазы (38), и (ii) те, которые улучшают устойчивость к уксусной кислоте E. coli , включая гены RecG (51) и AatA (39).Настоящее исследование было разработано для оценки потенциальной роли CAC и связанных путей в удалении уксусной кислоты.
A. aceti CAC превращает ацетат в CO 2 , что характерно для штаммов Acetobacter . Обязательным условием является эффективное превращение ацетата в ацетил-КоА, которое может быть выполнено с помощью AckA / Pta или Acs. Активность Pta и Acs увеличивается в A. aceti при окислении ацетата (49). Устойчивое окисление ацетил-КоА и ассимиляция ацетата требует полного CAC.Однако SCS не был обнаружен в черновой последовательности генома A. aceti , и активность в лизатах клеток не обнаружена.
При выращивании в присутствии глюкозы A. aceti способен ассимилировать углерод из ацетата (39) или этанола (46) посредством ацетата. Об активности изоцитратлиазы и малатсинтазы сообщалось в клетках A. aceti , выращенных на ацетате в качестве единственного источника углерода (53), что согласуется с ассимиляцией ацетата глиоксилатным шунтом.Однако гены ферментов глиоксилатного шунта не обнаружены ни в одном геноме AAB (19, 45). Таким образом, A. aceti должен ассимилировать ацетат другим путем. Альтернативные пути присутствуют у нескольких других α-протеобактерий, в которых отсутствует изоцитратлиаза (1).
Об активности изоцитратлиазы и малатсинтазы сообщалось в клетках A. aceti , выращенных на ацетате в качестве единственного источника углерода (53), что согласуется с ассимиляцией ацетата глиоксилатным шунтом.Однако гены ферментов глиоксилатного шунта не обнаружены ни в одном геноме AAB (19, 45). Таким образом, A. aceti должен ассимилировать ацетат другим путем. Альтернативные пути присутствуют у нескольких других α-протеобактерий, в которых отсутствует изоцитратлиаза (1).
Наши результаты показывают, что A. aceti содержит полный, но неортодоксальный САС, в котором белок устойчивости к уксусной кислоте AarC (SCACT) превращает сукцинил-КоА и ацетат в сукцинат и ацетил-КоА. Этот обходной путь облегчает метаболическую активацию и окисление ацетата и составляет часть условно необходимого пути детоксикации, который необходим для выживания при высоких концентрациях ацетата при низком pH, но не требуется для роста при низких концентрациях ацетата, даже при таком же низком pH.
гомологов AarC. Насколько нам известно, SCACT не был идентифицирован в других аэробных α-протеобактериях. Из четырех AAB с доступными в настоящее время последовательностями генома только G. oxydans имеют неполный САС (20, 45). Полные геномные последовательности AAB G. bethesdensis CGDNIh2 (19) и A. cryptum содержат гены SCS. A. cryptum также содержит близкое соответствие с AarC (см. Таблицу S1 в дополнительном материале). Гены, похожие на aarC , обнаружены у многих протеобактерий, но последовательности, однозначно связанные с активностью SCACT, не идентифицированы.
Анаэробный синтез АТФ в гидрогеносомах трихомонад и характерных митохондриях трипаносом и некоторых гельминтов требует как SCACT, так и SCS, которые превращают ацетил-КоА, АДФ и P i в ацетат, CoA и ATP в присутствии сукцината (55 , 56). Гидрогеносомный SCACT из Trichomonas vaginalis (55) очень похож на AarC, но последовательность митохондриального SCACT из Trypanosoma brucei (47) подобна только в области активного сайта, (S / T) E (Q / N) GL.
Активность SCACT обнаружена у Aspergillus nidulans (6). Недавно идентифицированный фермент, ответственный за эту активность (CoaT), имеет равную активность с ацетатом, пропионатом и ацетоацетатом в присутствии сукцинил-КоА (13). A. nidulans CoaT и аналогичные предполагаемые белки в шести родственных грибах, все из которых содержат предполагаемые митохондриальные целевые последовательности, очень похожи на AarC (см. Таблицу S1 в дополнительном материале) и могут функционировать как митохондриальные ферменты SCACT.SCACT является одним из небольшого числа ферментов, обнаруженных как в гидрогеносомах, так и в некоторых митохондриях (21). Считается, что каждая органелла происходит от α-протеобактерий, группы, которая включает AAB. Использование SCACT для другой метаболической цели может объяснить отличительное распределение этого гена.
Сравнение с другими байпасами CAC.
Helicobacter pylori не содержит нескольких типичных компонентов САС (27, 44), включая Mdh, который заменен на Mqo, и SCS, который заменен на сукцинил-КоА: ацетоацетат-КоА-трансфераза (10). AarC также способен поддерживать активность сукцинил-КоА: ацетоацетат-КоА-трансферазы, хотя и с существенно более низким значением k
AarC также способен поддерживать активность сукцинил-КоА: ацетоацетат-КоА-трансферазы, хотя и с существенно более низким значением k
cat / K m , чем у реакции SCACT (Таблица 3). Учитывая вероятность того, что концентрация ацетата намного выше, чем концентрация ацетоацетата в цитоплазме A. aceti и что генетические эксперименты связывают aarC с метаболизмом ацетата (16, 17), AarC, вероятно, будет действовать в основном как SCACT.
Mycobacterium tuberculosis заменяет α-кетоглутаратдегидрогеназу и SCS на α-кетоглутаратдекарбоксилазу и янтарную полуальдегиддегидрогеназу (54). (Активность этих ферментов не была обнаружена в лизатах A. aceti [данные не показаны].) Как и в случае обхода SCACT A. aceti , обход янтарного полуальдегида позволяет избежать стадии, зависящей от CoA и нуклеотидов, и обнаруживается с помощью анализ несовместимых требований к кофактору.
Все три байпаса сохраняют типичный циклический ход САС и тем самым отличаются от «разветвленных» вариантов САС факультативными и облигатными анаэробами (11).
Потенциальные преимущества SCACT. Реакции тиотранэстерификации, осуществляемые КоА-трансферазами, имеют тенденцию к небольшим | Δ G | значения. Для SCACT несколько неблагоприятная реакция ( K
экв. = 0,14; Δ G = +1,2 ккал / моль) снижается при высоких уровнях ацетата или когда ацетил-КоА быстро потребляется САС, то есть во время интенсивной аэрации. Почти термонейтральность реакции SCACT, вероятно, будет поддерживаться в A. aceti при снижении pH цитоплазмы (32), тогда как равновесие фосфорилирования на уровне субстрата, осуществляемое SCS, вероятно, будет зависеть от pH.
Использование SCACT обходит потребность в нуклеотидах в CAC и потребность в начальном фосфорилировании или аденилировании ацетата (рис. 4), снижая чувствительность потока через CAC к энергетическому состоянию клетки. Аналогичным образом снижается метаболическая потребность в свободном КоА. Таким образом, для детоксикации уксусной кислоты путем необратимого окисления потребуется только благоприятная регенерация восстановленных кофакторов пути.
РИС. 4.
Необычный A. aceti CAC окисляет ацетат.Серые стрелки указывают на гены САС, которые не обнаружены в черновой последовательности генома A. aceti 1023 (Kappock et al., Неопубликовано). У каждого есть функциональная замена. Используя периплазматические дегидрогеназы, A. aceti производит большие количества уксусной кислоты из этанола и вынужден бороться с постоянным притоком первой. Вместе с полным путем окислительного фосфорилирования этот вариант CAC действует в восьмиэлектронном окислении уксусной кислоты: CH 3 COOH + 2 O 2 → 2 CO 2 + 2 H 2 O.Этот путь пропускает AckA, Acs и SCS ( suCD ), единственные шаги, на которые могут напрямую влиять пулы цитоплазматических нуклеотидов, и снижает количество ферментов, которые имеют свободные субстраты CoA, с двух до одного. Первоначальные акцепторы электронов, два NAD + , один FAD и один убихинон (предположительно Q9 в A. aceti ), дадут более низкий выход энергии, чем канонический CAC, но имеют дополнительную необратимую ступеньку Mqo- опосредованное снижение хинона. Гены ферментов глиоксилатного шунта изоцитратлиаза и малатсинтаза не обнаружены в A.aceti 1023.
aceti ), дадут более низкий выход энергии, чем канонический CAC, но имеют дополнительную необратимую ступеньку Mqo- опосредованное снижение хинона. Гены ферментов глиоксилатного шунта изоцитратлиаза и малатсинтаза не обнаружены в A.aceti 1023.
Диссимиляция ацетата. Доверие к полному CAC для удаления ацетата может объяснить высокую потребность в оксигенации культур A. aceti , которая становится критической при высоких уровнях уксусной кислоты и низких значениях pH (34, 37). Вместе с ADH-опосредованным окислением этанола CAC обеспечивает энергией многие клеточные процессы, включая поддержание протонного градиента. Временное лишение O 2 резко снижает жизнеспособность клеток в течение нескольких минут, что не согласуется с потерей энергии из-за медленного коллапса трансмембранного градиента pH.Вместо этого представленные здесь данные показывают, что полный CAC, включая SCACT, поддерживает восьмиэлектронное окисление ацетата до двух молекул CO 2 (рис. 4). Цитоплазматический ацетат будет быстро накапливаться, если реокисление кофактора замедлится, что согласуется с быстрой потерей жизнеспособности клеток при неадекватной аэрации культуры при высоких внешних уровнях уксусной кислоты.
4). Цитоплазматический ацетат будет быстро накапливаться, если реокисление кофактора замедлится, что согласуется с быстрой потерей жизнеспособности клеток при неадекватной аэрации культуры при высоких внешних уровнях уксусной кислоты.
У многих грамотрицательных бактерий НАДН ограничивает поток САС в анаэробных условиях. Цитратсинтаза (40) и Mdh (57) восприимчивы к аллостерическому ингибированию и ингибированию продукта соответственно.Однако как кислотоустойчивый H. pylori , так и ацидофильный A. aceti содержат формы цитрат-синтазы, нечувствительные к НАДН (15, 44). Оба организма также заменяют Mdh на Mqo. Восстановление убихинона под действием Mqo более благоприятно, чем реакция Mdh, и в значительной степени не зависит от отношения концентрации НАДН к концентрации НАД + , причем оба фактора будут способствовать образованию оксалоацетата. У A. aceti эти адаптации могут избежать подавления диссимиляции ацетата в периоды стресса уксусной кислотой.
Кинетическая характеристика. Кинетические и механистические параметры SCACT определяют его потенциальное влияние (я) на метаболический поток. A. aceti выживает в> 0,5 M уксусной кислоте при низком pH, но штаммы, разрушенные aar , не могут выжить в 50 мМ внешней уксусной кислоте (16). Поскольку, вероятно, нет разницы в проницаемости ацетата, удаление ацетата из цитоплазмы путем окисления становится критическим при ∼10 −2 M. Наблюдаемые значения ацетата K m находятся в этом диапазоне (Таблица 3), что соответствует условно необходимая роль детоксикации для aarC .Вблизи K м скорость SCACT линейно зависит от цитоплазматической концентрации ацетата, уменьшаясь по мере истощения ацетата. При более низком pH ацетат K m меньше, что может увеличить скорость окисления ацетата во время интенсивного кислотного стресса.
Экологически приемлемый путь перетока? Секреция ацетата многими бактериями происходит из-за активации пути перетока углерода во время анаэробиоза или при перенапряжении центральных метаболических путей (58). NAD + и CoA восстанавливаются, когда ацетил-CoA превращается в CoA и ацетат, диффундирующее соединение, которое покидает цитоплазму, но может быть восстановлено в стационарной фазе. В AAB интенсивное периплазматическое окисление этанола гарантирует, что градиент концентрации ацетата всегда направлен внутрь, предотвращая диффузную потерю избыточного цитоплазматического ацетата. Окисление ацетата до CO 2 с помощью SCACT-модифицированного A. aceti CAC допускает диффузную потерю углерода, поскольку CO 2 предпочтительнее бикарбоната при низком pH и может проникать через мембраны бактериальных клеток (33).
NAD + и CoA восстанавливаются, когда ацетил-CoA превращается в CoA и ацетат, диффундирующее соединение, которое покидает цитоплазму, но может быть восстановлено в стационарной фазе. В AAB интенсивное периплазматическое окисление этанола гарантирует, что градиент концентрации ацетата всегда направлен внутрь, предотвращая диффузную потерю избыточного цитоплазматического ацетата. Окисление ацетата до CO 2 с помощью SCACT-модифицированного A. aceti CAC допускает диффузную потерю углерода, поскольку CO 2 предпочтительнее бикарбоната при низком pH и может проникать через мембраны бактериальных клеток (33).
Регулятор CAC в межгенной области aarA -to- aarC . Новые назначения в межгенной области A. aceti aarA -to- aarC объясняют несколько ранее сбивающих с толку наблюдений, включая единственный ген X и aarB , которые, по-видимому, уникальны для A. aceti . Ген X заменен на tyrA (хоризматмутаза), который выполняет ключевой этап биосинтеза ароматических аминокислот. Деструкторы в области X / tyrA были неактивны (16), открытие, которое теперь можно приписать недостаточности питания.Кроме того, aarB заменяется на sixA . SixA регулирует ArcA / ArcB, один из небольшого числа глобальных регуляторов в E. coli , который подавляет синтез аэробных метаболических ферментов в анаэробных условиях (3, 26). Нокаут ArcA увеличивает активность фермента CAC (43), предполагая, что SixA-зависимое подавление этого ингибирующего регулятора будет стимулировать прохождение через CAC. Переназначение этой условно существенной области последовательности на sixA согласуется с известными функциями AarA и AarC и предполагает важную роль для восприятия O 2 .
Деструкторы в области X / tyrA были неактивны (16), открытие, которое теперь можно приписать недостаточности питания.Кроме того, aarB заменяется на sixA . SixA регулирует ArcA / ArcB, один из небольшого числа глобальных регуляторов в E. coli , который подавляет синтез аэробных метаболических ферментов в анаэробных условиях (3, 26). Нокаут ArcA увеличивает активность фермента CAC (43), предполагая, что SixA-зависимое подавление этого ингибирующего регулятора будет стимулировать прохождение через CAC. Переназначение этой условно существенной области последовательности на sixA согласуется с известными функциями AarA и AarC и предполагает важную роль для восприятия O 2 .
Заключение. Продукт гена A. aceti 1023 aarC представляет собой SCACT. Это назначение примиряет ранее запутанные биохимические и генетические данные относительно важной роли (й) aarC в устойчивости к уксусной кислоте и метаболизме. SCACT обходит SCS, который отсутствует в геноме; позволяет включать ацетат без фосфорилирования на уровне субстрата; и делает возможным удаление диффузно захваченного цитоплазматического ацетата путем окисления ацетил-КоА в виде легко диффундирующего CO 2 .
SCACT обходит SCS, который отсутствует в геноме; позволяет включать ацетат без фосфорилирования на уровне субстрата; и делает возможным удаление диффузно захваченного цитоплазматического ацетата путем окисления ацетил-КоА в виде легко диффундирующего CO 2 .
Кислая среда и заживление ран: обзор
Применение кислоты значительно способствует процессу заживления ран следующим образом.
Инфекционный контроль. Инфекция — одна из наиболее распространенных причин длительного хронического поражения ран. 31,32 Хроничность начинается с бактерий. Присутствие бактерий и бактериальных продуктов, таких как эндотоксины и металлопротеиназы, может вызвать нарушения в упорядоченной схеме заживления ран, тем самым влияя на каждую из фаз заживления. 31,32 Таким образом, инфекция является частой причиной плохого заживления ран, особенно при хронических ранах, поэтому значительное уменьшение количества бактерий важно при лечении хронических ран. Большинство патогенных бактерий, связанных с инфицированными ранами человека, нуждаются в значении pH> 6; их рост тормозится более низкими значениями pH. 33-35 Нанесение кислот на поверхность раны снижает pH инфицированных поверхностей и делает среду непригодной для роста и размножения бактерий.Это подтверждено микробиологическими исследованиями и быстрой очисткой инфицированных поверхностей. 36 Таким образом, применение кислоты эффективно для удаления бактериальных патогенов из загрязненных или инфицированных раневых лож за счет создания кислой среды, неблагоприятной для роста бактериальных патогенов, присутствующих на поверхности раны ( Таблица 1 ).
Большинство патогенных бактерий, связанных с инфицированными ранами человека, нуждаются в значении pH> 6; их рост тормозится более низкими значениями pH. 33-35 Нанесение кислот на поверхность раны снижает pH инфицированных поверхностей и делает среду непригодной для роста и размножения бактерий.Это подтверждено микробиологическими исследованиями и быстрой очисткой инфицированных поверхностей. 36 Таким образом, применение кислоты эффективно для удаления бактериальных патогенов из загрязненных или инфицированных раневых лож за счет создания кислой среды, неблагоприятной для роста бактериальных патогенов, присутствующих на поверхности раны ( Таблица 1 ).
Повышение антимикробной активности. Было показано, что различные кислоты увеличивают антимикробную активность местных противомикробных препаратов, таких как йод и серебро, которые вводятся в повязки для ран. 37,38 На биодоступность активных свободных ионов металлов в ране влияют многочисленные факторы, включая растворимость ионов металлов, которая, как известно, увеличивается с понижением pH. 39,40 Экспериментально доказано, что pH влияет на активность серебросодержащих повязок для ран в отношении устойчивых к антибиотикам бактерий. 38 Было обнаружено, что снижение pH с 8,5 до 5,5 увеличивает активность серебряных повязок против как грамположительных, так и грамотрицательных бактерий. 38 Эти данные подтверждают, что pH поверхности раны играет важную роль в антимикробной активности и улучшает свойства серебра. 41 Было показано, что использование 2% аскорбиновой кислоты для создания кислой среды в тропическом климате, где теплая погода и щелочность среды делают 0,1% сульфадиазина серебра менее эффективным, усиливает действие сульфадиазина серебра, тем самым делая это более эффективно. 17 Альгинатные повязки на раны, содержащие альгиновую кислоту, делают среду раны немного более кислой, что помогает повысить эффективность и биодоступность ионного серебра, присутствующего в альгинатных повязках для ран. 38,42 Обеспечивая максимальное противомикробное действие повязки на рану, можно достичь положительных клинических результатов.
39,40 Экспериментально доказано, что pH влияет на активность серебросодержащих повязок для ран в отношении устойчивых к антибиотикам бактерий. 38 Было обнаружено, что снижение pH с 8,5 до 5,5 увеличивает активность серебряных повязок против как грамположительных, так и грамотрицательных бактерий. 38 Эти данные подтверждают, что pH поверхности раны играет важную роль в антимикробной активности и улучшает свойства серебра. 41 Было показано, что использование 2% аскорбиновой кислоты для создания кислой среды в тропическом климате, где теплая погода и щелочность среды делают 0,1% сульфадиазина серебра менее эффективным, усиливает действие сульфадиазина серебра, тем самым делая это более эффективно. 17 Альгинатные повязки на раны, содержащие альгиновую кислоту, делают среду раны немного более кислой, что помогает повысить эффективность и биодоступность ионного серебра, присутствующего в альгинатных повязках для ран. 38,42 Обеспечивая максимальное противомикробное действие повязки на рану, можно достичь положительных клинических результатов. Повязка из альгината серебра продемонстрировала широкий спектр антимикробной барьерной активности внутри повязки против всех изолятов ран, включая Candida albicans и устойчивый к ванкомицину штамм Enterococcus при pH 5,5 по сравнению с pH 7,7 6,42
Повязка из альгината серебра продемонстрировала широкий спектр антимикробной барьерной активности внутри повязки против всех изолятов ран, включая Candida albicans и устойчивый к ванкомицину штамм Enterococcus при pH 5,5 по сравнению с pH 7,7 6,42
Изменение протеазной активности. Протеазы — это ферменты, способные расщеплять белки. Они производятся самой раной, а также бактериями. Ферментативная активность протеаз зависит от количества протеаз и присутствия ингибиторов протеаз. 6 Каждый фермент протеазы показывает оптимальную и максимальную активность фермента при определенном значении pH, при котором белок расщепляется быстрее, чем при других значениях pH. Например, ферменты эластаза и плазмин проявляют оптимальную ферментативную активность при pH 8, эластаза нейтрофилов максимально активна при pH 8.3, а фермент уреаза, продуцируемый бактериями, более активен в щелочных условиях. Похоже, протеазы более активны в щелочных условиях, а их конечные продукты токсичны для тканей раны. Снижение pH до более кислой среды может снизить активность этих ферментов, тем самым уменьшая образование и токсичность их конечных продуктов. 43
Снижение pH до более кислой среды может снизить активность этих ферментов, тем самым уменьшая образование и токсичность их конечных продуктов. 43
Выпуск кислорода. Кислород является основным требованием для выживания клеток в организме человека, и насыщение кислородом ран имеет жизненно важное значение в процессе заживления ран.Было замечено, что более низкая степень оксигенации ухудшает иммунитет и процесс заживления ран. Большая часть кислорода требуется для производства радикалов-окислителей (т.е. для уничтожения бактерий). Это основа иммунитета к бактериальной инфекции, вызываемой стафилококками, E. coli, Klebsiella и другими бактериями, обычно участвующими в раневых инфекциях. Кислород также необходим для синтеза коллагена и эпителизации. На выделение кислорода влияет кислая среда.Низкое значение pH приводит к эффекту Бора (т. Е. К увеличению количества доступного кислорода в клетках). 9,44 Доставка кислорода к поврежденной ткани, особенно в хронических ранах, зависит как от перфузии, так и от диффузии. Улучшение оксигенации тканей повышает сопротивляемость инфекциям и способствует заживлению. 45,46 Снижение pH на 0,6 единицы высвобождает на 50% больше кислорода, а сдвиг pH на 0,9 единицы вызывает 5-кратное увеличение выделения кислорода. 9 Местное парциальное давление кислорода в тканях (PO2) необходимо для подачи кислорода в поврежденные и заживающие ткани.Процесс заживления ран, особенно хронических ран, сравнительно выше, если PO 2 > 40 мм рт. однако процесс заживления нарушается, если PO 2 составляет <20 мм рт. 45 Было замечено, что любой фактор, который может вызвать даже небольшое изменение pH раны, может значительно изменить доступный приток кислорода к тканям и нарушить процесс заживления ран. 9 PO 2 также влияет на репликацию фибробластов, которая оптимально происходит при PO 2 около 40-60 мм рт.На эпителиальные клетки также влияет PO 2 , и было продемонстрировано, что эпителизация лучше происходит в тканях, хорошо насыщенных кислородом.
Улучшение оксигенации тканей повышает сопротивляемость инфекциям и способствует заживлению. 45,46 Снижение pH на 0,6 единицы высвобождает на 50% больше кислорода, а сдвиг pH на 0,9 единицы вызывает 5-кратное увеличение выделения кислорода. 9 Местное парциальное давление кислорода в тканях (PO2) необходимо для подачи кислорода в поврежденные и заживающие ткани.Процесс заживления ран, особенно хронических ран, сравнительно выше, если PO 2 > 40 мм рт. однако процесс заживления нарушается, если PO 2 составляет <20 мм рт. 45 Было замечено, что любой фактор, который может вызвать даже небольшое изменение pH раны, может значительно изменить доступный приток кислорода к тканям и нарушить процесс заживления ран. 9 PO 2 также влияет на репликацию фибробластов, которая оптимально происходит при PO 2 около 40-60 мм рт.На эпителиальные клетки также влияет PO 2 , и было продемонстрировано, что эпителизация лучше происходит в тканях, хорошо насыщенных кислородом. Это также объясняет эффективность гиперберической кислородной терапии. 45
Это также объясняет эффективность гиперберической кислородной терапии. 45
Снижение токсичности конечных бактериальных продуктов. Снижение pH и создание более кислой среды также снижает токсичность конечных бактериальных продуктов, таких как аммиак, который высвобождается из мочевины под действием фермента уреазы. Аммиак токсичен для ткани раны, а также приводит к образованию щелочной среды, которая не подходит для процесса заживления ран. 7
Эпителизация и ангиогенез. Кислая среда также способствует эпителизации и ангиогенезу. В гистопатологическом исследовании хронических раневых инфекций было показано, что использование лимонной кислоты усиливает эпителизацию, и было обнаружено, что она запускает процесс заживления ран за счет ускорения роста фибробластов и неоваскуляризации, что увеличивает микроциркуляцию ран, что способствует формированию здоровой грануляционной ткани, что приводит к более быстрое заживление ран. 36 Одной из важных причин стимулирования эпителизации является повышенная оксигенация местных тканей из-за кислой среды.

 ru: главная страница / / Техническая информация / / Физический справочник / / Плотность. Вес. Удельный вес. Насыпная плотность. / / Плотность водных растворов органических кислот: муравьиная кислота, уксусная кислота, трихлоруксусная кислота, молочная кислота, лимонная кислота при 20°C в зависимости от массовой доли (%)
ru: главная страница / / Техническая информация / / Физический справочник / / Плотность. Вес. Удельный вес. Насыпная плотность. / / Плотность водных растворов органических кислот: муравьиная кислота, уксусная кислота, трихлоруксусная кислота, молочная кислота, лимонная кислота при 20°C в зависимости от массовой доли (%) 5
5
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
 0
0
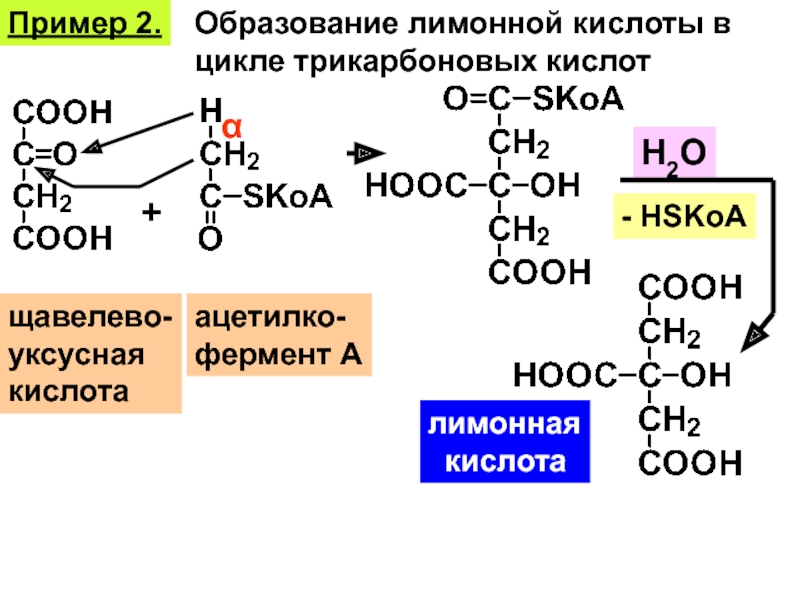 М. Большой химический справочник — Мн.: Современная школа, 2005. — 608 с.
М. Большой химический справочник — Мн.: Современная школа, 2005. — 608 с.
