Сравнение уксусной кислоты и лимонной кислоты: СХОДСТВО И РАЗЛИЧИЕ УКСУСНОЙ КИСЛОТЫ И ЛИМОННОЙ
Лимонная кислота отличие от винной
В отличие от большинства технически чистых металлов титан и его сплавы устойчивы в растворах хлоридов как при комнатной температуре, так и при повышенных (скорость коррозии оценивается значениями 0,02 мм/год). В большинстве органических сред титан обладает высокой коррозионной стойкостью. К таким средам относятся бензин, метиловый и этиловый спирты, толуол, фенол, формальдегид, трихлорэтан, уксусная, муравьиная, молочная, винная, лимонная, никотиновая кислоты и ряд других органических соединений. [c.191]
Влияние органических растворителей на сорбцию титана и скандия анионитом АВ-17 из растворов щавелевой, винной и лимонной кислот отличается от влияния тех же органических растворителей на сорбцию этих элементов из растворов минеральных кислот. Органические растворители увеличивают сорбцию обоих элементов из раствора минеральных кислот (при молярной концентрации ионов меньше единицы). В растворах же более сильных комплексующих реагентов растворители на сорбцию элементов анионитом оказывают противоположное влияние сорбция скандия в их присутствии увеличивается, а титана — уменьшается. Следовательно, степень и глубина протекания реакций комплексообразования в раствора оказывает большее влияние на сорбцию элементов в водно-органических средах, чем в водных. [c.220]
В растворах же более сильных комплексующих реагентов растворители на сорбцию элементов анионитом оказывают противоположное влияние сорбция скандия в их присутствии увеличивается, а титана — уменьшается. Следовательно, степень и глубина протекания реакций комплексообразования в раствора оказывает большее влияние на сорбцию элементов в водно-органических средах, чем в водных. [c.220]
Способ, позволяющий отличить лимонную кислоту от винной. 1 г исследуемой твердой кислоты растирают в ступке с 10 мл концентрированной серной кислоты и затем полученную смесь нагревают в пробирке в течение 1 часа до 50—60° в случае лимонной кислоты смесь остается бесцветной, в присутствии винной окрашивается в черный цвет. Этим путем удается обнаружить даже небольшие примеси винной кислоты в лимонной. [c.264]
Ti отличается высокой коррозионной стойкостью в морской, промышленной, сельской и некоторых других атмосферах. Он стоек в большинстве органических кислот. Лишь в муравьиной, щавелевой, винной, лимонной кислотах, а также в смеси ледяной уксусной кислоты с уксусным ангидридом Ti подвержен интенсивной коррозии. [c.64]
Лишь в муравьиной, щавелевой, винной, лимонной кислотах, а также в смеси ледяной уксусной кислоты с уксусным ангидридом Ti подвержен интенсивной коррозии. [c.64]
ИЛИ винной кислотами. Лучшие результаты были получены со смолой ЗДЭ-10, обработанной лимонной кислотой. Постоянная дегустационная комиссия не обнаружила разницы в аромате и вкусе контрольных и опытных образцов. Однако Контрольные образцы отличались несколько менее интенсивной окраской. Химический состав этих вин приведен в табл. 2. [c.407]
Успех разделения зависит от многих условий природы смолы и ее измельчения, длины колонки, скорости промывания, природы комплексообразующего реактива и, особенно, pH среды. Для разделения редкоземельных элементов в качестве промывного реактива- обычно применяют растворы солей органических кислот (лимонной, винной и др.), образующих с лантанидами различной стойкости комплексные анионы. Среди них особой прочностью отличаются комплексы, в которых аддендами являются радикалы лимонной кислоты. [c.395]
[c.395]
Реакции, позволяющие отличить винную кислоту от лимонной, см. на стр. 264. [c.260]
Различная растворимость карбонатов в винной и лимонной кислотах и в бисульфате калия. Этот вопрос, временами затрагивавшийся прежними исследователями, был впервые изучен Болтоном и много времени спустя многие из его выводов были подтверждены последующими исследователями . Твердые органические кислоты, как лимонная и винная, вследствие различного их действия на разные карбонатные минералы оказались очень хорошими реактивами для отличия последних. О действии бисульфата калия как реактива для различения карбонатов имеются как ранние данные , так и полученные более поздними исследователями Здесь достаточно сослаться на указанные оригинальные работы, особенно на статьи Болтона, где приведены данные о растворимости самых разнообразных минералов как в указанных выше реактивах, так и в других (неорганических) растворителях. [c.957]
Лимонная кислота, в отличие от винной, не восстанавливает аммиачный раствор нитрата серебра. Раствор в концентрированной серной кислоте при нагревании приобретает бледно-желтую окраску, тогда как винная кислота дает коричневую окраску. [c.159]
Раствор в концентрированной серной кислоте при нагревании приобретает бледно-желтую окраску, тогда как винная кислота дает коричневую окраску. [c.159]
В табл. 16 представлены данные о коррозионной стойкости титана и кислотостойкой хромоникельмолибденомедистой нержавеющей стали в органических кислотах при различных температурах и различных условиях аэрации. В муравьиной кислоте всех концентраций при температуре до 100°С в условиях воздушной аэрации титан полностью устойчив. При температуре кипения в кислоте концентраций 25% и выше без аэрацйи титан подвергается сильной коррозии. Так же неустойчив титай в муравьиной кислоте концентраций 25 50% (температура 60 и 100° С) и в атмосфере азота. Нержавеющая сталь менее стойка, чем титан в муравьиной кислоте, и в отличие от него стойкость ее выше в атмосфере азота, чем в аэрированных растворах. Титан неустойчив в кипящих 100%-ной трихлоруксусной кислоте и в 50%-ной лимонной кислоте. Нержавеющая сталь в этих средах также неустойчива. В щавелевой кислоте при повышенных температурах титан имеет низкую стойкость даже в разбавленных растворах, нержавеющая сталь в этой кислоте во много раз более стойка, чем титан. В растворах молочной, дубильной и винной кислот титан полностью устойчив. В солянокислом анилине титан имел высокую стойкость, нержавеющая сталь в этой среде подвергалась сильной коррозии с образованием глубоких язв. [c.30]
В щавелевой кислоте при повышенных температурах титан имеет низкую стойкость даже в разбавленных растворах, нержавеющая сталь в этой кислоте во много раз более стойка, чем титан. В растворах молочной, дубильной и винной кислот титан полностью устойчив. В солянокислом анилине титан имел высокую стойкость, нержавеющая сталь в этой среде подвергалась сильной коррозии с образованием глубоких язв. [c.30]
Лимонная, винная, щавелевая и муравьиная кислоты не оказывают никакого влияния на ход титрования шестивалентного вольфрама в среде концентрированной соляной кислоты [791. Получаемые в этом случае кривые ничем не отличаются от кривых титрования чистых солянокислых растворов. При снижении концентрации соляной кислоты в растворе, а также в присутствии одной лишь лимонной, винной или муравьиной кислоты при титровании наблюдается образование вольфрамовой сини. Вольфрам при этом количественно не восстанавливается до пятивалентного состояния. При титровании муравьинокислых растворов происходит не только посинение растворов, но и выделение в осадок вольфрамовой кислоты. [c.105]
[c.105]
Винная кислота [7] невыгодно отличалась от лимонной медленностью очистки и большим перетравом. [c.5]
Окрашивание при нагревании. Лимонную кислоту М 0жно отличить от щавелевой, винной н малоноаой кислот по синей или зеленой окраске, получающейся следующим путем. В трубку из тугоплавкого стекла, запаянную с одного конца,, вносят по меньшей мере 0,01 лимонной кис-. юты и избыток а.М. м пака (3. м.ч). Другой конец трубки запаивают так, чтобы над жидкостью оставалось очень неболыное пустое пространство. Трубку иагревают в течение й час. при 110—120 . Охладив, обламывают конец трубки и содержимое ее выливают в неглубокую фарфоровую чашку. Спустя несколько часов, при стоянии чашки на свету, продукт реакции окрашивается в синий или зеленый цвет. [c.427]
Окисление йодной кислотой позволяет также отличить винную кислоту от лимонной, равно как и соли одной кислоты от другой. Винная кислота с двумя o eдни ш гидроксильными группами в молекуле, вероятно, окисляется в глиоксиловую кислоту и реагирует с фуксинсернистой кислотой вследствие распада до формальдегида, тогда как лимонная кислота не претерпевает заметных изменений. [c.243]
[c.243]
На этой ргакции основан чрезвычайно чувствительный метод обнаружения сахаров . В отличие от большинства других методов обнаружения редуцирующих сахаров альдегиды не мешают реакции. Другие восстановители, такие, как гидразин, гидроксиламин, сульфиты, винная и лимонная кислоты, не реагируют с хлоридом третрафенилтетразолия. Аскорбиновая кислота, которую по ее химическому строению можно отнести к редуцирующим сахарам, дает аналогичную последним реакцию. [c.532]
Успешное осуществление ионообменного разделения сначала группы редкоземельных элементов, а затем и трехвалентных трансурановых элементов [41—46] с применением таких элю-ептов,как растворы натриевых, калиевых и аммониевых солей лимонной, винной, молочной и а-оксиизомасляной кислот оказалось возможным благодаря тому обстоятельству, что все они образуют комплексы с данными элементами. При прочих равных условиях разделение элементов происходит тем лучше, чем больше отличаются по прочности комплексы разделяемых элементов. Имеющиеся экспериментальные данные о ионообменном разделении элементов группы трансуранов показывают, что наиболее прочные комилексы их образуются, по-видимому, в растворах а-оксиизомасляной кислоты, затем молочной и лимонной кислот. [c.183]
Имеющиеся экспериментальные данные о ионообменном разделении элементов группы трансуранов показывают, что наиболее прочные комилексы их образуются, по-видимому, в растворах а-оксиизомасляной кислоты, затем молочной и лимонной кислот. [c.183]
В то же время авторы [691] наблюдали при введении 0,004— 0,02 М Н3РО4 или Н2С2О4 в растворы 10 М НС1, содержащие вольфрам, сглаживание волн и смещение их в катодную область. При постоянной концентрации 0,02 М фосфорной или щавелевой кислот и уменьшении концентрации НС1 с 10 до 1 М обе волны смещаются в катодную область и четко отличаются от волны окисления ртути. На фоне 5 М ПС1 в присутствии различных количеств винной или лимонной кислот четко проявляются две волны. [c.148]
Разделение скандия и титана. Как было показано, в присутствии органических растворителей сорбционное. поведение элементов в растворах щавелевой, винной и лимонной кислот резко отличается от их сорбционного поведения в водных растворах названных кислот. Это различие мы положили в основу хроматографических методов отделения скандия от титана. На катионите КУ-2Х8-Н разделение проведено с использованием в качестве элюента 0,02 М раствора щавелевой кислоты, содержащего 60% ДМФ. В этих условиях скандий сорбируется на 100%, а титан практически не сорбируется. На анионите AB-I7X8- 2O4 разделение проведено из 0,2 М раствора щавелевой кислоты, содержащего 70% метилового спирта. С катионита и анионита скандий легко десорбируется 4 М НС1. Диаметр колонок 0,5 см, скорость пропускания растворов 1 капля/сек, высота слоя ионита h различна в зависимости от условий опыта. Данные о разделении приведены в таблице. [c.221]
Это различие мы положили в основу хроматографических методов отделения скандия от титана. На катионите КУ-2Х8-Н разделение проведено с использованием в качестве элюента 0,02 М раствора щавелевой кислоты, содержащего 60% ДМФ. В этих условиях скандий сорбируется на 100%, а титан практически не сорбируется. На анионите AB-I7X8- 2O4 разделение проведено из 0,2 М раствора щавелевой кислоты, содержащего 70% метилового спирта. С катионита и анионита скандий легко десорбируется 4 М НС1. Диаметр колонок 0,5 см, скорость пропускания растворов 1 капля/сек, высота слоя ионита h различна в зависимости от условий опыта. Данные о разделении приведены в таблице. [c.221]
Присутствие хлоридов, сульфатов, фосфатов в титруемом растворе исключается, так как эти ионы также образуют малорастворимые осадки с закисной ртутью. Равным образом исключается применение органических кислот — винной, щавелевой или лимонной, которые иногда применяются для связывания вольфрама (VI) в комплексное соединение с тем, чтобы в его. присутствии определять молибден (например, при колориметрических определениях) с этими кислотами ртуть также образует осадки. Что касается катионов, то их влияние на определение молибдена и вольфрама обусловлено растворимостью соответствующих вольфраматов и мо-либдатов в данной среде. Так, например, в присутствии бария определение вольфрама делается практически невозможным, так как вольфрамат бария отличается весьма малой растворимостью в разбавленных кислотах и, следовательно, увлечет вольфрам в осадок до титрования, а более сильное подкисление приведет, как уже упоминалось, к растворению вольфрамата ртути. [c.193]
присутствии определять молибден (например, при колориметрических определениях) с этими кислотами ртуть также образует осадки. Что касается катионов, то их влияние на определение молибдена и вольфрама обусловлено растворимостью соответствующих вольфраматов и мо-либдатов в данной среде. Так, например, в присутствии бария определение вольфрама делается практически невозможным, так как вольфрамат бария отличается весьма малой растворимостью в разбавленных кислотах и, следовательно, увлечет вольфрам в осадок до титрования, а более сильное подкисление приведет, как уже упоминалось, к растворению вольфрамата ртути. [c.193]
Для маскировки ионов л1еталлов особенно широкое применение нашли такие лиганды, как ЭДТА, N , S N и др. Комплексы с ЭДТА отличаются высокой устойчивостью, растворимостью в воде их образование можно регулировать путем изменения кислотности среды в соответствии с константами устойчивости комплексонатов. Цианид-ионы также образуют высокоустойчивые и растворимые в воде комплексы преимущественно с иона ми металлов, проявляющими тенденцию к комплексообразованию с лигандами, содержащими атомы азота в качестве доноров. Очень высокой устойчивостью отличаются низкоспиновые цианидные комплексы ионов с заполненными или почти заполненными i-орбита-лями с высокой энергией стабилизации кристаллического поля. Эти же соображения в большой степени справедливы и для тиоцианатных комплексов. Наряду с этими лигандами успешно, применяются в качестве маскирующих реагентов некоторые гидроксикарбоновые кислоты (лимонная, винная), галоген-ионы (Р , С1 ), амины (аммиак, этилендиамин, триэтаноламин), серу- и фосфорсодержащие лиганды (тиосульфат, тиокарбамид, фосфаты, фосфорорганические соединения) и др. Далее приведены некоторые характерные примеры использования маскирующих реагентов рассмотренных типов в различных видах количественного анализа. [c.425]
Очень высокой устойчивостью отличаются низкоспиновые цианидные комплексы ионов с заполненными или почти заполненными i-орбита-лями с высокой энергией стабилизации кристаллического поля. Эти же соображения в большой степени справедливы и для тиоцианатных комплексов. Наряду с этими лигандами успешно, применяются в качестве маскирующих реагентов некоторые гидроксикарбоновые кислоты (лимонная, винная), галоген-ионы (Р , С1 ), амины (аммиак, этилендиамин, триэтаноламин), серу- и фосфорсодержащие лиганды (тиосульфат, тиокарбамид, фосфаты, фосфорорганические соединения) и др. Далее приведены некоторые характерные примеры использования маскирующих реагентов рассмотренных типов в различных видах количественного анализа. [c.425]
Сначала о воде. Водопроводная вода отличается от дождевой и снеговой тем, ЧТО обычно содеркит много солей кальция и магния. В такой воде плохо мылится мыло, на коже образуется налет труднорастворимых солей, и она неприятно стягивается. Все это означает, что вода жесткая (см. Приложение 4). Жесткость воды частично устраняется кипячением. А можно умягчить воду, добавляя молочную, винную или лимонную кислоты. [c.172]
Приложение 4). Жесткость воды частично устраняется кипячением. А можно умягчить воду, добавляя молочную, винную или лимонную кислоты. [c.172]
Как известно, безводная серная кислота отщепляет окись углерода от ряда кар-боковых кислот, а разложение муравьиной кислоты с помощью серной кислоты является общепринятым лабораторным методом получения окиси углерода. Уксусный ангиярид оказывает аналогичное действие на муравьиную и щавелевую кислоты, но в отличие от серной кислоты (и ее ангидрида), при температурах до 100° не выделяет окиси угле рода из таких кислот, как, например янтарная, молочная, яблочная, винная, малоновая и лимонная. На этом были основаны способ распознавания, газовый и объемный методы определения муравьиной и щавелевой кислоты [I. 2], а также и уксусного ангидрида [ ]. Было также установлено, что разложение муравьиной [ ] и щавелевой [6] кислот уксусным ангидридом катализируется органическими основаниями, содержащими третичный атом азота. Наоборот, азотистые соединения, не являющиеся основаниями или содержащие азот другой степени замещения, не катализируют реакцию. Предложено пользоваться этой закономерностью в тех случаях, когда желают определить, является ли данное соединение основанием и содержится ли в нем третичный атом азота. [c.341]
Предложено пользоваться этой закономерностью в тех случаях, когда желают определить, является ли данное соединение основанием и содержится ли в нем третичный атом азота. [c.341]
Позже человек овладел процессами мыловарения и крашения тканей и т. д. Но в то время люди еще не умели выделять органические вещества в чистом виде, а пользовались обычно их природными смесями. Только в конце XVIII в. были получены такие вещества, как мочевина, винная, лимонная и яблочная кислоты и многие другие. Одновременно выяснилось и своеобразие органических соединений, их отличие от неорганических веществ. Это дало повод Я. Берцелиусу — знаменитому шведскому химику XIX столетия, высказать ошибочную мысль, что в живой природе элементы повинуются иным законам, чем в безжизненной , и что органические вещества могут получаться только под воздействием особой жизненной силы . Так возникла идеалистическая теория, получившая название виталистической (от лат. vita — жизнь). [c.6]
С 1769 по 1785 гг. Шееле удалось выделить целый ряд кислот, таких как винная, лимонная, яблочная, галловая, молочная, мочевая и щавелевая. В 1773 г. Роуэлл получил из человеческой мочи мочевину. Выделенные из растительных и животных организмов соединения имели между собой много общего, но резко отличались от неорганических веществ. Так появилось понятие органическая химия — раздел науки, изучающий соединения, выделенные из организмов (Берцелиус, 1807 г.). При этом полагали, что органические вещества могут образовываться только в живых организмах благодаря присущей только им жизненной силе vis ultalis). [c.17]
Шееле удалось выделить целый ряд кислот, таких как винная, лимонная, яблочная, галловая, молочная, мочевая и щавелевая. В 1773 г. Роуэлл получил из человеческой мочи мочевину. Выделенные из растительных и животных организмов соединения имели между собой много общего, но резко отличались от неорганических веществ. Так появилось понятие органическая химия — раздел науки, изучающий соединения, выделенные из организмов (Берцелиус, 1807 г.). При этом полагали, что органические вещества могут образовываться только в живых организмах благодаря присущей только им жизненной силе vis ultalis). [c.17]
Применение фотохимических реакций весьма перспективно в волюмометрических методах анализа, поскольку многие вещества под действием света разлагаются с выделением газообразных продуктов. Этими методами можно определять диазосоединения, в особенности такие, как о-диазофенолы и о-диазонафтолы, высокочувствительные к свету [85]. Определение этих соединений обычными методами отличается значительными трудностями [73]. Волюмометрическим методом определяют карбоновые кислоты, в том числе уксусную, щавелевую, муравьиную, малоновую, ЭДТА, винную, лимонную, а также ацетон, ацетальдегид, формальдегид, некоторые эфиры и многие другие органические соединения. [c.12]
Волюмометрическим методом определяют карбоновые кислоты, в том числе уксусную, щавелевую, муравьиную, малоновую, ЭДТА, винную, лимонную, а также ацетон, ацетальдегид, формальдегид, некоторые эфиры и многие другие органические соединения. [c.12]
Не упомянутые в этой главе, но описанные ниже органические кислоты представляют собой нелетучие кристаллические вещества, водные растворы которых вызывают в жидкой фазе значительную коррозию черных металлов уже при обычной температуре. Аустенитные хромоникелевые и особенно хромоникелемолибденовые стали отличаются высокой коррозионной Стойкостью в растворах чистых кислот, но не всегда обеспечи ают надежную работу в горячих производственных смесях. Дайные по коррозионной стойкости металлов в растворах щавелевой, лимонной и винной кислот приведены в соответствующих разделах. [c.23]
По коррозионной стойкости в ряде практически важных сред титан превосходит такие широко используемые в промышленности металлы и сплавы, как нержавеющие стали, алюминий и его сплавы. Титан устойчив в окислительных средах даже в присутствии больших количеств хлор-ионов, но корродирует в растворах восстановительных кислот, таких как серная, соляная. Однако его коррозионная стойкость в этих средах может быть повышена добавлением в раствор небольших количеств окислителей (например, азотной кислоты, хлора, ионов Т — -, Ре — и других) или окислительных (анодных) ингибиторов. Титан имеет высокую коррозионную стойкость в различных атмосферах (морской, промышленной, сельской). Данные семилетних испытаний показали, что скорость коррозии не превышала 0,0001 мм1год. В морской воде как на поверхности, так и на больших глубинах (данные 3-летних испытаний) титан не подвергается коррозии. Длительные испытания (4—8 лет) титана в разнообразных почвах показали отсутствие коррозионных потерь. Титан отличается высокой стойкостью в большинстве органических сред. Исключение составляют муравьиная, щавелевая, винная, лимонная, смесь ледяной уксусной кислоты с уксусным ангидридом, в которых титан корродирует с большой скоростью.
Титан устойчив в окислительных средах даже в присутствии больших количеств хлор-ионов, но корродирует в растворах восстановительных кислот, таких как серная, соляная. Однако его коррозионная стойкость в этих средах может быть повышена добавлением в раствор небольших количеств окислителей (например, азотной кислоты, хлора, ионов Т — -, Ре — и других) или окислительных (анодных) ингибиторов. Титан имеет высокую коррозионную стойкость в различных атмосферах (морской, промышленной, сельской). Данные семилетних испытаний показали, что скорость коррозии не превышала 0,0001 мм1год. В морской воде как на поверхности, так и на больших глубинах (данные 3-летних испытаний) титан не подвергается коррозии. Длительные испытания (4—8 лет) титана в разнообразных почвах показали отсутствие коррозионных потерь. Титан отличается высокой стойкостью в большинстве органических сред. Исключение составляют муравьиная, щавелевая, винная, лимонная, смесь ледяной уксусной кислоты с уксусным ангидридом, в которых титан корродирует с большой скоростью. [c.226]
[c.226]
Для отличия щавелевой кислоты от яблочной, винной и лимонной рекомендуют (69, 261) пользоваться 17 /о-ным раствором AgNO в 15 /д-ной HNOg (р. 1бЗг). С этим реактивом кристаллический осадок дает только щавелевая кислота. [c.188]
Применение растворимых хромовых комплексов. Ванна для крашения шерсти содержит 10% глауберовой соли и 6—8% концентрированной серной кислоты от веса шерсти. Два важнейших фактора — концентрация кислоты и время кипячения — должны быть выбраны в определенных пределах для каждого отдельного красителя. Перечисленные хромовые комплексы отличаются исключительной прочностью к продолжительному кипячению с минеральной кислотой, хотя некоторые из них (например Неолановый желтый R) значительно легче подвергаются действию кислоты, чем другие. Однако все металлические комплексы являются чувствительными к действию многоосновных кислот, как, например, щавелевой, лимонной и винной. [c.605]
Сложные эфиры органических кислот. Применяемые обычно пластификаторы этого типа очень мало токсичны. При кормлении крыс диоктилфталатом в сравнительно больших дозах токсический эффект не наблюдался. Однако предполагают, что низшие фталаты более токсичны -вследствие их большей растворимости. Для пищевой упаковки используется пленка из хлорированного каучука, пластифицированная бутилстеаратом по-видимому, сложные эфиры жирных кислот наименее токсичны из всех пластификаторов. Бутилацетилрицинолеат характеризуется наибольшей растворяющей способностью, но также не токсичен, хотя имеет неприятный запах. Недавно появившиеся ацетоглицериды достаточно безвредны для применения в пищевой промышленности, а по растворяющей способности значительно превосходят сложные эфиры жирных кислот. Применяют также этиловый и бутиловый эфиры лимонной и винной кислот, если допускается очень малая токсичность. Эфиры на основе фенола, по-видимому, должны отличаться большой токсичностью вследствие выделения фенола при гидролизе поэтому не следует допускать их соприкос-иовения с пищевыми продуктами.
Применяемые обычно пластификаторы этого типа очень мало токсичны. При кормлении крыс диоктилфталатом в сравнительно больших дозах токсический эффект не наблюдался. Однако предполагают, что низшие фталаты более токсичны -вследствие их большей растворимости. Для пищевой упаковки используется пленка из хлорированного каучука, пластифицированная бутилстеаратом по-видимому, сложные эфиры жирных кислот наименее токсичны из всех пластификаторов. Бутилацетилрицинолеат характеризуется наибольшей растворяющей способностью, но также не токсичен, хотя имеет неприятный запах. Недавно появившиеся ацетоглицериды достаточно безвредны для применения в пищевой промышленности, а по растворяющей способности значительно превосходят сложные эфиры жирных кислот. Применяют также этиловый и бутиловый эфиры лимонной и винной кислот, если допускается очень малая токсичность. Эфиры на основе фенола, по-видимому, должны отличаться большой токсичностью вследствие выделения фенола при гидролизе поэтому не следует допускать их соприкос-иовения с пищевыми продуктами. [c.341]
[c.341]
Все соедине1тя, содержащие спиртовые гидроксильные группы, дают положительную реакцию, но красная окраска возникает только тогда, когда анализируемое вещество растворимо в растворителе, используемом для приготовления раствора реагента (обычно в бензоле). Так, например, эфиры глицерина и молочной кислоты дают положительную реакцию в отличие от сахаров. Соединения, которые наряду со спиртовыми гидроксильными группами содержат карбоксифенильную нли основную азотсодержащую группу, не вступают в эту реакцию. Так, например, молочная, винная, лимонная, миндальная кислоты и холин дают отрицательные реакции. Фенолы, кетоны и простые эфиры образуют серовато-зеленые сольваты с оксинатом ванадия, окраска реагента в их присутствии не изменяется. [c.161]
ФС.2.1.0024.15 Лимонная кислота | Фармакопея.рф
Содержимое (Table of Contents)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Лимонная кислота ФС. 2.1.0024.15
2.1.0024.15
Лимонной кислоты моногидрат
Acidum citricum Взамен ФС 42-0008-00
2-Гидроксипропан-1,2,3-трикарбоновая кислота, моногидрат
С6Н8О7 Н 2О М.м. 210,14
Содержит не менее 99,5 % лимонной кислоты С6Н8О7 в пересчете на безводное вещество.
Описание
Прозрачные бесцветные кристаллы или белый или почти белый кристаллический порошок или бесцветные гранулы. Выветривается в сухом воздухе.
Растворимость
Очень легко растворима в воде, легко или очень легко растворима в спирте 96 %.
Подлинность
Субстанцию предварительно высушивают при температуре 100 – 105 °С в течение 2 ч.
- ИК-спектр. Инфракрасный спектр поглощения субстанции, полученный в дисках с калия бромидом, в области частот от 4000 до 400 см -1 по положению полос поглощения должен соответствовать спектру стандартного образца лимонной кислоты.
- Качественная реакция. 1 г субстанции растворяют в 10 мл воды; полученный раствор должен окрашивать бумагу конго красного в синий или зеленый цвет.
- Качественная реакция. 0,05 г субстанции растворяют в 0,5 мл уксусного ангидрида и нагревают; через 20 – 40 с должно появиться розово-фиолетовое окрашивание, переходящее в карминово-красное при прибавлении 0,1 мл пиридина.
- Качественная реакция. 0,5 г субстанции растворяют в 5 мл воды, нейтрализуют 1 М раствором натрия гидроксида (около 7 мл), прибавляют 10 мл 7,35 % раствора кальция хлорида и нагревают до кипения; появляется осадок белого цвета.
*Прозрачность раствора
Растворяют 20 г субстанции в свежепрокипяченной и охлажденной воде и разбавляют водой до 100 мл; полученный раствор (раствор 1) должен быть прозрачным (ОФС «Прозрачность и степень мутности жидкостей»).
50 г субстанции, предназначенной для производства лекарственных препаратов для парентерального применения, растворяют в свежепрокипяченной и охлажденной воде и разбавляют водой до 100 мл; полученный раствор (раствор 2) должен быть прозрачным(ОФС «Прозрачность и степень мутности жидкостей») .
*Цветность раствора
Окраска раствора 1, полученного в испытании на «Прозрачность раствора», не должна превышать эталоны сравнения Y7, BY7 или GY7 (ОФС «Степень окраски жидкостей»).
Для субстанции, предназначенной для производства лекарственных препаратов для парентерального применения, раствор 2, полученный в испытании на «Прозрачность раствора», должен быть бесцветным (ОФС «Степень окраски жидкостей») .
Легко обугливающиеся вещества
1,0 г субстанции помещают в пробирку, прибавляют 10 мл серной кислоты концентрированной, тотчас нагревают на водяной бане при температуре (90 ± 1) °С точно в течение 60 мин и быстро охлаждают; окраска полученного раствора не должна превышать окраски раствора, состоящего из 1 мл красного раствора и 9 мл желтого раствора (ОФС «Степень окраски жидкостей», метод 1).
Щавелевая кислота
Не более 0,036 %. 0,80 г субстанции растворяют в 4 мл воды, прибавляют 3 мл хлористоводородной кислоты концентрированной, 1 г цинка гранулированного, кипятят в течение 1 мин и выдерживают в течение 2 мин. Надосадочную жидкость переносят в пробирку, содержащую 0,25 мл 1 % раствора фенилгидразина гидрохлорида, и нагревают до кипения. Раствор переносят в градуированный цилиндр вместимостью 25 мл, быстро охлаждают, прибавляют равный объем хлористоводородной кислоты концентрированной и 0,25 мл 5 % раствора калия феррицианида, перемешивают и выдерживают в течение 30 мин. Интенсивность розовой окраски полученного раствора не должна превышать интенсивность окраски эталонного раствора, приготовленного параллельно таким же образом с использованием 4 мл 0,01 % раствора щавелевой кислоты.
Сульфаты
Не более 0,015 % (ОФС «Сульфаты», метод 2). 2,0 г субстанции растворяют в воде и разбавляют водой до 30 мл.
*Алюминий
Не более 0,00002 % (ОФС «Алюминий»).
испытуемый раствор. 20,0 г субстанции растворяют в 100 мл воды.
Эталонный раствор. К 2 мл стандартного раствора алюминий-иона
(2 мкг/мл) прибавляют 10 мл ацетатного буферного раствора с рН 6,0 и 98 мл воды и перемешивают.
Контрольный раствор. К 10 мл ацетатного буферного раствора с рН 6,0 прибавляют 100 мл воды и перемешивают.
Тяжелые металлы
Не более 0,002 % (ОФС «Тяжёлые металлы»). 0,5 г субстанции растворяют в 10 мл воды.
Вода
От 7,5 % до 9,0 % (ОФС «Определение воды»). Около 0,5 г (точная навеска) субстанции растворяют в 20 мл метанола безводного.
Сульфатная зола
Не более 0,1 % (ОФС «Сульфатная зола»). Для определения используют около 1,0 г (точная навеска) субстанции.
Остаточные органические растворители
В соответствии с требованиями ОФС «Остаточные органические растворители».
*Бактериальные эндотоксины
Не более 0,5 ЕЭ на 1 мг субстанции (ОФС «Бактериальные эндотоксины»).
Микробиологическая чистота
В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение
Около 0,5 г (точная навеска) субстанции растворяют в 50 мл воды и титруют 1 М раствором натрия гидроксида до по-
явления слабо-розовой окраски (индикатор – 0,5 мл 1 % раствора фенолфталеина).
Параллельно проводят контрольный опыт.
1 мл 1 М раствора натрия гидроксида соответствует 64,05 мг лимонной кислоты С6Н8О7.
Хранение
В хорошо укупоренной упаковке.
*Контроль по показателям качества «Прозрачность раствора», «Цветность раствора», «Алюминий» и «Бактериальные эндотоксины» проводят в субстанциях, предназначенных для производства лекарственных препаратов для парентерального применения.
Скачать в PDF ФС.2.1.0024.15 Лимонная кислота
Поделиться ссылкой:
Водорастворимые полимеры POLYOX — Загущение чистящих составов на основе кислот.
 . Статьи компании «ООО «Силоксан»»
. Статьи компании «ООО «Силоксан»»
Водорастворимые полимеры POLYOX могут использоваться для улучшения функциональных качеств многих чистящих составов, содержащих органические кислоты, неорганические кислоты, гидроокись аммония и другие жидкости. Небольшие дозы этих полимеров значительно повышают вязкость и регулируют текучесть таких составов, давая возможность:
- Формировать композиции различной консистенции – от густых вязких жидкостей до каучукоподобных составов, – обеспечивающие многообразие применений.
- «Фиксировать» активность на нужном участке. Это особенно полезно для вертикальных поверхностей, с которых возможно стекание чистящих средств.
- Регулировать скорость поступления загущенных жидкостей в водные системы.
Примерами таких жидкостей, которые можно загустить или превратить в гели, являются органические кислоты (лимонная кислота, щавелевая кислота и т.д.), неорганические кислоты (фосфорная кислота, соляная кислота и т.д.), основания, гидроокись аммония и поверхностно-активные вещества (TERGITOL® Nonionic Surfactant 15-S-9 и алкиларилсульфонаты).
Преимущества регулирования вязкости:
Регулирование вязкости различных жидкостей для специальных целей часто очень важно, особенно если жидкость химически активна. Например, во время чистки вертикальных поверхностей соляной кислотой, кислота часто стекает и воздействует на непредусмотренные для этого участки. При удалении кислотой брызг цементного раствора со стекла возникают проблемы, связанные с попаданием кислоты на металлические оконные рамы, что вызывает коррозию металла. Растворители красок со сниженной текучестью уже известны, но в их состав обычно входит воск, замедляющий испарение летучих компонентов, поэтому они оставляют на обработанной поверхности нежелательную пленку.
Минимальное разбрызгивание и возможность регулирования текучести для удобного использования – важные свойства как для производственных задач, так и для домашнего хозяйства. Например, гигиенические моющие средства для стеклянных поверхностей могут безопасно и удобно подаваться из пластмассовых туб. Можно приготовить составы с твердыми частицами, а также другими жидкостями (например, неводоосновными чистящими средствами или специальными спиртами) с их замедленным выходом из состава. Полимеры POLYOX не будут загущать щелочи (гидроокиси натрия или калия), поскольку не растворяются в них. Однако они могут загустить гидроокись аммония.
Можно приготовить составы с твердыми частицами, а также другими жидкостями (например, неводоосновными чистящими средствами или специальными спиртами) с их замедленным выходом из состава. Полимеры POLYOX не будут загущать щелочи (гидроокиси натрия или калия), поскольку не растворяются в них. Однако они могут загустить гидроокись аммония.
Загущение чистящих составов на основе кислот:
Выбор различных марок водорастворимых полимеров POLYOX® дает возможность приготовить чистящие составы на основе кислот с широким диапазоном вязкости. При хранении в них не образуются нерастворимые примеси или цветные осадки. Однако из-за своей высокомолекулярной природы незащищенные полимеры POLYOX могут разлагаться в некоторых кислотных системах. По этой причине часто рекомендуется вводить в составы специальные стабилизаторы.
Методика растворения:
Во избежание разбрызгивания коррозионно-активных жидкостей необходимо применять специальные приемы. Кроме того, следует не забывать о выделении теплоты при растворении, особенно в случае серной кислоты. Разбавление кислоты всегда следует производить, медленно добавляя концентрированную кислоту к водной фракции состава и спокойно, но тщательно перемешивая смесь. После разбавления часто рекомендуется охладить систему до температуры окружающей среды и лишь после этого вводить в нее остальные компоненты состава.
Кроме того, следует не забывать о выделении теплоты при растворении, особенно в случае серной кислоты. Разбавление кислоты всегда следует производить, медленно добавляя концентрированную кислоту к водной фракции состава и спокойно, но тщательно перемешивая смесь. После разбавления часто рекомендуется охладить систему до температуры окружающей среды и лишь после этого вводить в нее остальные компоненты состава.
Полимеры POLYOX, подобно другим высокомолекулярным полимерам, требуют особого внимания при растворении. Высокая вязкость получаемых растворов может препятствовать растворению, если не используется правильная методика. По возможности наиболее удобно сначала приготовить суспензию полимера POLYOX в жидком компоненте состава, которые не растворяют полимер. Изопропанол, часто используемый в составе чистящих средств, может быть применен для приготовления суспензии. В случаях, когда суспензионная методика не применима, рекомендуется рассыпать полимер POLYOX по поверхности активно перемешиваемой воды. Независимо от используемой методики очень полезна некоторая практика и приобретение навыков. Приготовление вязких, но не желеобразных составов занимает около часа.
Независимо от используемой методики очень полезна некоторая практика и приобретение навыков. Приготовление вязких, но не желеобразных составов занимает около часа.
Для получения подробных методик и рекомендаций по оборудованию запросите копию публикации «POLYOX® Water-Soluble Resins Dissolving Techniques.» («Методики растворения водорастворимых полимеров POLYOX®«).
Выбор марки полимера с подходящей вязкостью:
Полимеры POLYOX являются водорастворимыми и доступны в широком диапазоне молекулярных масс. С увеличением молекулярной массы полимера повышается его эффективность как загустителя. Доступные марки полимеров и диапазоны вязкости приведены в Таблице 1.
Таблица 1 — Марки водорастворимых полимеров POLYOX®
Марка полимера POLYOX |
Приблизительный мол. | Вязкость при 25°C, cP (сантипуаз) по Брукфильду | |||
5% раствор(2) | 1% раствор(2) | Насадка | Скорость, об./мин. | ||
WSR N-750 | 300 000 | 600-1000 | — | № 1 | 10 |
WSR N-3000 | 400 000 | 2250-3350 | — | № 1 | 2 |
WSR-205 | 800 000 | 4500-8800 | — | № 2 | 2 |
WSR-1105 | 900 000 | 8800-17 600 | — | № 2 | 2 |
WSR-301 | 4 000 000 | — | 1850-3850 | № 1 | 2 |
WSR-коагулянт | 6 000 000 | — | 5500-8000 | № 2 | 2 |
(1) Приблизительный вес является средним значением молекулярных весов, полученных при реологических измерениях.
(2) Весовой процент полимера POLYOX – по отношению к воде. В методике подготовки растворов используется немного изопропилового спирта в качестве диспергирующей добавки, что приводит к небольшому разбавлению раствора.
Эффективность полимеров POLYOX, часто используемых для загущения кислотных составов, показана в Таблице 2:
Таблица 2 — Эффективность полимеров POLYOX в загущении кислотных составов.
Марка полимера POLYOX® | Загущающая эффективность | Эффективность вязкости состава | Вязкоупругость состава |
WSR-коагулянт WSR-301 WSR-1105 WSR-205, WSR N-3000 WSR N-750 | Самая высокая | | | Самая низкая | Самая низкая | | | Самая высокая | Самая высокая | | | Самая низкая |
При выборе подходящей по вязкости марки полимера иногда приходится идти на компромисс. Выбирая марки полимеров из верхней части списка, потребуется гораздо меньше загустителя, но при этом полученные составы будут более подвержены падению вязкости со временем и обладать излишне высокой вязкоупругостью. Если та же вязкость рецептуры достигнута использованием более высокой концентрации менее эффективного полимера (с более низким молекулярным весом), вязкость состава обычно более стабильна во времени, и его вязкоупругость (тягучесть) не так высока. Как исходный вариант для загущения кислотных составов рекомендуется марка POLYOX WSR N-3000.
Выбирая марки полимеров из верхней части списка, потребуется гораздо меньше загустителя, но при этом полученные составы будут более подвержены падению вязкости со временем и обладать излишне высокой вязкоупругостью. Если та же вязкость рецептуры достигнута использованием более высокой концентрации менее эффективного полимера (с более низким молекулярным весом), вязкость состава обычно более стабильна во времени, и его вязкоупругость (тягучесть) не так высока. Как исходный вариант для загущения кислотных составов рекомендуется марка POLYOX WSR N-3000.
В то время как вполне предсказуема загущающая способность водных составов различными марками полимера POLYOX, часто трудно точно предсказать степень загущения ими кислотных составов. С достаточной уверенностью можно утверждать лишь, что вязкость большинства кислотных составов получается ниже, чем у водных составов. Кроме того, с увеличением ионной силы или концентрации ионов в рецептуре вязкость состава уменьшается. Такие сильные кислоты, как HCl и HNO3, которые практически полностью ионизированы, дают обратную зависимость между значением вязкости по мере увеличения концентрации кислоты.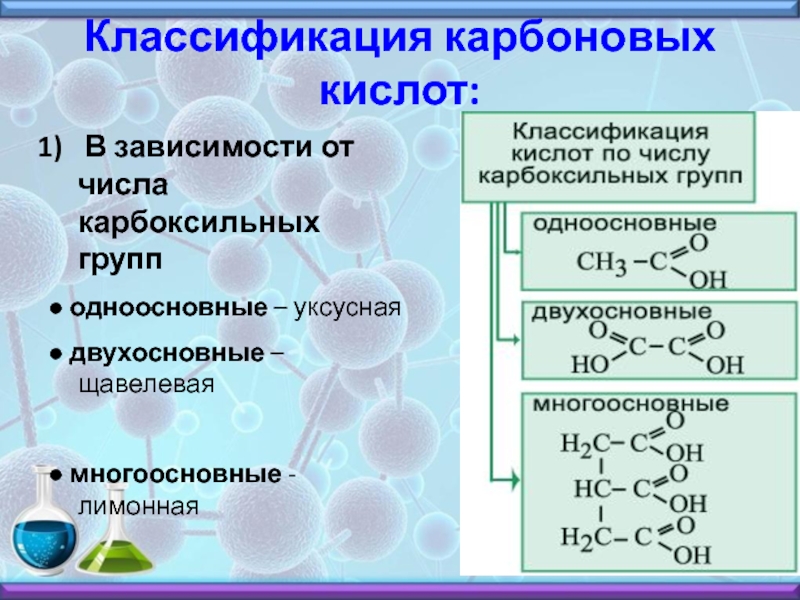 Однако в составах с кислотами, являющимися слабыми электролитами (и сильнее ионизированными в разбавленном состоянии), с увеличением концентрации кислоты вязкость растет. Это можно наблюдать на примере щавелевой, уксусной, лимонной и даже фосфорной кислоты. Кроме того, присутствие спирта приводит к резкому увеличению вязкости кислотного состава. Так, если часть воды в рецептуре заместить изопропиловым спиртом или этиленгликолем (порядка 8 процентов от веса состава), то вязкость состава увеличится. Уровень вязкости исходной, незагущенной, кислоты также влияет на конечную вязкость состава. При одинаковой концентрации кислоты равное количество загустителя приводит к намного более высокой вязкости состава с серной кислотой, чем с соляной или азотной кислотами.
Однако в составах с кислотами, являющимися слабыми электролитами (и сильнее ионизированными в разбавленном состоянии), с увеличением концентрации кислоты вязкость растет. Это можно наблюдать на примере щавелевой, уксусной, лимонной и даже фосфорной кислоты. Кроме того, присутствие спирта приводит к резкому увеличению вязкости кислотного состава. Так, если часть воды в рецептуре заместить изопропиловым спиртом или этиленгликолем (порядка 8 процентов от веса состава), то вязкость состава увеличится. Уровень вязкости исходной, незагущенной, кислоты также влияет на конечную вязкость состава. При одинаковой концентрации кислоты равное количество загустителя приводит к намного более высокой вязкости состава с серной кислотой, чем с соляной или азотной кислотами.
Стабилизация вязкости состава:
Незащищенные высокомолекулярные полимеры, растворенные в кислотах, часто имеют тенденцию к снижению своей загущающей эффективности со временем. Следовательно, необходимы стабилизаторы, гарантирующие продление срока хранения. Способность любого конкретного стабилизатора сохранять данный уровень вязкости зависит от многих факторов, включая природу и молекулярную массу растворенного полимера, а также тип загущаемой кислоты. При прочих равных условиях самой высокой стабильностью обладает состав, полученный с использованием наиболее высокой концентрации самого низкомолекулярного полимера-загустителя. Что касается влияния кислоты, обеспечить высокую вязкость составов на основе концентрированных азотной и соляной кислот зачастую трудно; задача стабилизации облегчается при разбавлении этих двух кислот. Другие кислоты, например уксусная и фосфорная, наоборот, легче стабилизируются в концентрированном виде. Замечено, что стабильность кислот зависит от степени их ионизации.
Способность любого конкретного стабилизатора сохранять данный уровень вязкости зависит от многих факторов, включая природу и молекулярную массу растворенного полимера, а также тип загущаемой кислоты. При прочих равных условиях самой высокой стабильностью обладает состав, полученный с использованием наиболее высокой концентрации самого низкомолекулярного полимера-загустителя. Что касается влияния кислоты, обеспечить высокую вязкость составов на основе концентрированных азотной и соляной кислот зачастую трудно; задача стабилизации облегчается при разбавлении этих двух кислот. Другие кислоты, например уксусная и фосфорная, наоборот, легче стабилизируются в концентрированном виде. Замечено, что стабильность кислот зависит от степени их ионизации.
Существует несколько способов стабилизации вязкости кислотных составов, загущаемых при помощи полимеров POLYOX. Выбор стабилизатора зависит от содержания кислоты, а также от способа приготовления состава.
Удобным и вполне надежным способом стабилизации вязкости является включение в состав от 5 до 10 весовых процентов спирта, например изопропанола. Этот способ применим к широкому спектру рецептур, и к тому же облегчает растворение полимера путем предварительного приготовления суспензии полимера в спирте. Предполагается, что спирт при этом в некоторой степени разлагается. В этих же целях можно использовать и другие спирты: этиловый, аллиловый, этиленгликоль, пропиленгликоль или любой другой спирт, имеющий отщепляемый водород.
Этот способ применим к широкому спектру рецептур, и к тому же облегчает растворение полимера путем предварительного приготовления суспензии полимера в спирте. Предполагается, что спирт при этом в некоторой степени разлагается. В этих же целях можно использовать и другие спирты: этиловый, аллиловый, этиленгликоль, пропиленгликоль или любой другой спирт, имеющий отщепляемый водород.
В некоторых случаях спирты оказываются неспособными обеспечить продолжительное хранение состава. Это особенно касается тех составов, которые были сильно загрязнены ионами железа или других каталитически активных переходных металлов в результате подготовки составов в незащищенном стальном оборудовании. Можно предложить несколько эффективных способов предотвращения этого вида дестабилизации вязкости. Наиболее очевидный способ – который однако не всегда может быть реализован – заключается в использовании для приготовления составов стеклянного или защищенного инертного оборудования. При отсутствии такого оборудования часто бывает достаточно просто максимально сократить время контакта кислоты с металлом. Например, водорастворимый полимер POLYOX предварительно полностью растворяют в воде или в водной составляющей рецептуры. На это может потребоваться около часа. После этого, на заключительной стадии, добавляют концентрированную кислоту и перемешивают смесь недолго, приблизительно 5 минут. Альтернативным способом обеспечения хорошей стабильности вязкости при возможном загрязнении смеси ионами переходных металлов является использование другого типа стабилизатора. Такую стабилизацию составов дает комбинация тиомочевины и хелатирующего агента, например лимонной кислоты. Каждая из этих добавок должна присутствовать в количестве приблизительно одного процента по весу конечного состава. Объединение стабилизаторов – тиомочевина/лимонная кислота наряду с вышеупомянутыми жидкими спиртами – гарантирует стабилизацию вязкости составов, независимо от материала, из которого изготовлен используемый смеситель.
Например, водорастворимый полимер POLYOX предварительно полностью растворяют в воде или в водной составляющей рецептуры. На это может потребоваться около часа. После этого, на заключительной стадии, добавляют концентрированную кислоту и перемешивают смесь недолго, приблизительно 5 минут. Альтернативным способом обеспечения хорошей стабильности вязкости при возможном загрязнении смеси ионами переходных металлов является использование другого типа стабилизатора. Такую стабилизацию составов дает комбинация тиомочевины и хелатирующего агента, например лимонной кислоты. Каждая из этих добавок должна присутствовать в количестве приблизительно одного процента по весу конечного состава. Объединение стабилизаторов – тиомочевина/лимонная кислота наряду с вышеупомянутыми жидкими спиртами – гарантирует стабилизацию вязкости составов, независимо от материала, из которого изготовлен используемый смеситель.
В комбинации тиомочевина/хелатный агент для стабилизации вязкости вместо лимонной кислоты могут применяться и другие комплексообразователи, например растворимые соли этилендиаминтетрауксусной кислоты или амины (диэтилентриамин). Однако эти заменители лимонной кислоты не должны использоваться в сочетании с жидкими спиртами без предварительной оценки их совместимости и производимых эффектов.
Однако эти заменители лимонной кислоты не должны использоваться в сочетании с жидкими спиртами без предварительной оценки их совместимости и производимых эффектов.
Можно также использовать другие типы стабилизаторов вязкости. Известно, что некоторые катионы переходных металлов останавливают или значительно замедляют падение вязкости в кислотных растворах. Особенно подходит для этих целей катион марганца (Mn++). Он может быть добавлен к составу в форме растворимой в воде соли MnCl2. Для стабилизации составов на основе разбавленных кислот достаточна концентрация этого иона порядка 1×10-5 мол/л. Для составов с более концентрированными кислотами надежнее использовать концентрацию стабилизатора 1×10-3 мол/л. При тщательно контролируемых условиях этот стабилизатор может быть чрезвычайно эффективным. Однако присутствие в растворе ионов других металлов может свести на нет или значительно снизить эффект стабилизации вязкости, обеспечиваемый ионами Mn++. Особенно этот эффект проявляется при наличии в составе ионов двух- или трехвалентного железа. Следовательно, те составы, которые содержат растворенное железо (технические марки соляной кислоты) или от которых требуется сохранение вязкости в течение нескольких дней на металлических поверхностях, должны стабилизироваться с помощью ранее упомянутых стабилизаторов: спиртов и систем тиомочевина/хелат.
Особенно этот эффект проявляется при наличии в составе ионов двух- или трехвалентного железа. Следовательно, те составы, которые содержат растворенное железо (технические марки соляной кислоты) или от которых требуется сохранение вязкости в течение нескольких дней на металлических поверхностях, должны стабилизироваться с помощью ранее упомянутых стабилизаторов: спиртов и систем тиомочевина/хелат.
Загущение неорганических кислот:
Неорганические (минеральные) кислоты являются основными ингредиентами многих чистящих составов. Наиболее часто в таких составах используется соляная кислота: при очистке и травлении железа, в санитарно-чистящих средствах для фаянся, средствах для очистки стеклянных поверхностей, а также облицовочных и кровельных материалов, обработки камней и гравирования и т.д. Фосфорная кислота часто служит для придания блеска алюминиевым поверхностям, а также как чистящее средство для керамической плитки. Для обеспечения продолжительности воздействия и регулирования степени ионизации неорганические кислоты часто используют в сочетании с детергентами и/или хелатирующими органическими кислотами.
В таблице 3 представлены данные по вязкости составов на основе ряда неорганических кислот, включая соляную, фосфорную, серную и азотную кислоты, с использованием водорастворимых полимеров POLYOX® в качестве загустителя. Данные приведены для свежеприготовленных и выдержанных какое-то время составов, что позволяет судить о степени падения вязкости и эффективности стабилизатора. Составы хранились при температуре окружающей среды, на свету, в закупоренных пробками прозрачных колбах из стекла марки «пирекс». Методики приготовления составов и способы измерения вязкости также представлены в таблице 3. Ввиду коррозионной активности этих составов, по возможности, использовались вискозиметры со стеклянными капиллярами. В данных примерах вязкость, определенная с использованием стеклянных капилляров, приведена в сантистоксах (cSt), а единицами измерения вязкости в вискозиметрах Брукфильда служат сантипуазы (cP). Для составов с неизменной плотностью эти две единицы измерения вязкости сопоставимы.
Таблица 3 — Неорганические кислоты с водорастворимыми полимерами POLYOX® в качестве загустителей
Неорганическая кислота | Полимер POLYOX® | Стабилизатор (1) | Методика растворения по рецепту-ре № | Исходная вязкость | Вязкость выдержанного состава | Метод определения вязкости |
10% HCl | 2% WSR-301 | A | 2 | 7500 (D) |
| G |
10% HCl | 2% WSR-301 | B | 3 | 21 000 (D) |
| G |
10% HCl | 4% WSR N-3000 | A | 2 | 360 (E) | 20 (50 дней) | F |
10% HCl | 4% WSR N-3000 | C | 2 | 360 (E) | 280 (50 дней) | F |
30% HCl | 6% WSR N-3000 | B | 3 | 6300 (E) | 2080 (30 дней) | F |
50% H3PO4 | 3% WSR N-3000 | A | 2 | 2870 (E) | 2500 (60 дней) | F |
50% H3PO4 | 3% WSR N-3000 | B | 4 | 6940 (E) | 6530 (80 дней) | F |
50% H3PO4 | 2% WSR-301 | A | 2 | 69 300 (D) | 28 200 (30 дней) | G |
50% H3PO4 | 2% WSR-301 | B | 4 | 80 600 (D) | 33 800 (30 дней) | G |
50% H3PO4 | 2% WSR-205 | B | 4 | 1160 (E) | 1110 (30 дней) | F |
30% H3PO4 | 2% WSR-205 | B | 4 | 450 (D) | 440 (30 дней) | H |
20% H3PO4 | 2% WSR-205 | B | 4 | 246 (D) | 240 (166 дней) | H |
10% H3PO4 | 2% WSR-205 | B | 4 | 180 (D) | 144 (166 дней) | H |
10% H2SO4 | 4% WSR N-3000 | A | 2 | 445 (E) | 30 (50 дней) | F |
10% H2SO4 | 4% WSR N-3000 | C | 2 | 445 (E) | 397 (50 дней) | F |
50% H2SO4 | 3% WSR N-3000 | A | 2 | 2882 (E) | 2086 (20 дней) | F |
10 % HNO3 | 4 % WSR N-3000 |
| 2 | 430 (E) | 250 (50 дней) | F |
10 % HNO3 | 4 % WSR N-3000 | C | 2 | 440 (E) | 260 (50 дней) | F |
50 % HNO3 | 3 % WSR N-3000 |
| 2 | 828 (E) | 212 (20 дней) | F |
(1) Поскольку растворы готовились в стеклянной посуде, не было необходимости добавлять к стабилизаторам тиомочевину (хелатирующий агент).
Стабилизирующая система | Единицы вязкости |
A – Без добавок стабилизаторов | D – сантипуазы (cP) |
B – Изопропиловый спирт (7,8 вес. %) | E – сантистоксы (cSt) |
C – Ионы марганца (Mn++), 1,0×10-4 мол/л | Примечание: сантипуаз = (сантистокс) x (плотность состава) |
Методы определения вязкости
F – Вискозиметр Cannon-Fenske, серия 500, со стеклянными капиллярами
G – Вискозиметр LVT, метод Брукфильда, насадка № 3, 1,5 об/мин
H – Вискозиметр RVF, метод Брукфильда, насадка № 2, 20 об/мин
Как видно из таблицы 3, вязкость загущенного раствора соляной кислоты (30 вес. %) со временем снижается. Это характерно для всех составов с высокой концентрацией соляной кислоты, независимо от природы используемого полимерного органического загустителя. Аналогично ведут себя составы с полиакриламидными смолами и ксантановыми каучуками. Следовательно, лучше всего загущать составы с концентрированной соляной кислотой, используя высокие концентрации низкомолекулярных марок POLYOX, улучшая тем самым стабильность вязкости во времени. Проблема падения вязкости становится менее актуальной, если использовать для составов разбавленные кислоты: соляную или другие сильные неорганические кислоты.
%) со временем снижается. Это характерно для всех составов с высокой концентрацией соляной кислоты, независимо от природы используемого полимерного органического загустителя. Аналогично ведут себя составы с полиакриламидными смолами и ксантановыми каучуками. Следовательно, лучше всего загущать составы с концентрированной соляной кислотой, используя высокие концентрации низкомолекулярных марок POLYOX, улучшая тем самым стабильность вязкости во времени. Проблема падения вязкости становится менее актуальной, если использовать для составов разбавленные кислоты: соляную или другие сильные неорганические кислоты.
Загущение органических кислот:
Чистящие составы на основе загущенных органических кислот дают определенные преимущества, отличные от неорганических кислот. Так например, составы с органическими кислотами обладают более мягким чистящим действием. Кроме того, что более важно, многие органические кислоты обладают хелатирующими свойствами и способны связывать ионы металлов. В отсутствие таких агентов несвязанные ионы металлов могут вызывать нежелательные эффекты: обесцвечивание, нестабильность, неприятные запахи, оставление налетов, выпадение осадков и т.д. Оксикарбоновые хелатирующие агенты, например лимонная, глюконовая и винная кислоты, обеспечивают низкое значение pH, требуемое при очистке металлических поверхностей. К тому же, они удерживают ионы металлов в растворе.
В отсутствие таких агентов несвязанные ионы металлов могут вызывать нежелательные эффекты: обесцвечивание, нестабильность, неприятные запахи, оставление налетов, выпадение осадков и т.д. Оксикарбоновые хелатирующие агенты, например лимонная, глюконовая и винная кислоты, обеспечивают низкое значение pH, требуемое при очистке металлических поверхностей. К тому же, они удерживают ионы металлов в растворе.
Лимонная кислота относится к довольно сильным органическим кислотам. Ее водные растворы с концентрацией 10 весовых процентов успешно удаляют остатки цемента со строительного оборудования и емкостей для работы с цементом, не повреждая металлические или окрашенные поверхности. Эта кислота особенно эффективна в качестве хелатирующего агента для связывания ионов меди, железа и никеля; она способна хелатировать большинство двух- и трехвалентных ионов металлов. Лимонной кислотой можно удалить налеты ржавчины и железа с поверхностей из нержавеющей стали. Ее используют также в процессах эмалировки стальных изделий. Травление лимонной кислотой подготавливает стальную поверхность и способствует лучшей адгезии эмалированного покрытия прямо к стали. Тогда как в случае обычного сернокислотного травления требуется предварительное нанесение керамического слоя. Нейтрализация одного из кислотных водородных ионов лимонной кислоты не снижает ее способности удерживать окись железа в растворе. Более того, черный оксид железа (Fe3O4) легче растворяется в лимонной кислоте, нейтрализованной гидроокисью аммония до значения pH = 4. Рецептура № 4 представляет типичный чистящий состав на основе лимонной кислоты (3,0 вес. %) с загустителем.
Травление лимонной кислотой подготавливает стальную поверхность и способствует лучшей адгезии эмалированного покрытия прямо к стали. Тогда как в случае обычного сернокислотного травления требуется предварительное нанесение керамического слоя. Нейтрализация одного из кислотных водородных ионов лимонной кислоты не снижает ее способности удерживать окись железа в растворе. Более того, черный оксид железа (Fe3O4) легче растворяется в лимонной кислоте, нейтрализованной гидроокисью аммония до значения pH = 4. Рецептура № 4 представляет типичный чистящий состав на основе лимонной кислоты (3,0 вес. %) с загустителем.
Загущение составов специального назначения:
Десятипроцентные (по весу) водные растворы гидроокиси аммиака можно превратить в густой гель, используя POLYOX WSR N-3000 (приблизительно 10 вес. %).
Растворы гидроокисей натрия и калия можно сгустить с помощью полимеров POLYOX только при сильном разбавлении этих растворов, чтобы значение pH было не выше 11 или 12.
Типовые рецептуры
Рецептура №1. Состав для очистки алюминия и других металлов
Компонент | вес. % |
Изопропиловый спирт, безводный | 10,0 |
Водорастворимый полимер POLYOX® WSR N-3000 | 4,0 |
Вода | 67,5 |
Лимонная кислота | 2,0 |
Тиомочевина | 1,0 |
Фосфорная кислота (орто, 85 вес. %) | 15,0 |
Неионогенное поверхностно-активное вещество TERGITOL® 15-S-9 | 0,5 |
Методика приготовления:
Сначала готовится суспензия полимера путем добавления водорастворимого полимера POLYOX® к безводному изопропиловому спирту. Суспензию следует перемешивать в течение 5 минут, чтобы гарантировать полное смачивание частиц полимера. При перемешивании к смеси последовательно добавляют воду, лимонную кислоту и тиомочевину в указанном порядке. Можно также предварительно растворить лимонную кислоту и тиомочевину в воде, а затем добавить полученный раствор к суспензии полимера. Для полного растворения полимера POLYOX требуется приблизительно от 30 до 90 минут, в зависимости от того, насколько хорошо были изначально перемешаны суспензия и вода. После того как полимер растворится, к смеси осторожно добавляют фосфорную кислоту и перемешивают в течение 5 минут. Неионогенное поверхностно-активное вещество TERGITOL 15-S-9 добавляют последним, чтобы минимизировать пенообразование. После этого смесь перемешивают еще несколько минут.
Суспензию следует перемешивать в течение 5 минут, чтобы гарантировать полное смачивание частиц полимера. При перемешивании к смеси последовательно добавляют воду, лимонную кислоту и тиомочевину в указанном порядке. Можно также предварительно растворить лимонную кислоту и тиомочевину в воде, а затем добавить полученный раствор к суспензии полимера. Для полного растворения полимера POLYOX требуется приблизительно от 30 до 90 минут, в зависимости от того, насколько хорошо были изначально перемешаны суспензия и вода. После того как полимер растворится, к смеси осторожно добавляют фосфорную кислоту и перемешивают в течение 5 минут. Неионогенное поверхностно-активное вещество TERGITOL 15-S-9 добавляют последним, чтобы минимизировать пенообразование. После этого смесь перемешивают еще несколько минут.
Зависимость вязкости состава от марки полимера POLYOX®:
По рецептуре №1 можно приготовить составы с широким диапазоном вязкостей, выбирая различные по вязкости марки полимера POLYOX. Это отражено в таблице 4. В данной серии составов суммарное содержание полимера POLYOX и воды поддерживается постоянным – 71,5% от общего веса состава.
Это отражено в таблице 4. В данной серии составов суммарное содержание полимера POLYOX и воды поддерживается постоянным – 71,5% от общего веса состава.
Таблица 4 — Вязкость составов на основе фосфорной кислоты с загустителем
Рецептура | Водорастворимый полимер POLYOX® | Вязкость состава при 60 об/мин (cP) | |
вес. % | Марка | ||
1a | 4.0 | WSR N-750 | 720 |
1b | 8.0 | WSR N-750 | 5720 |
1c | 3.0 | WSR-205 | 844 |
1d | 5. | WSR-205 | 5030 |
1e | 2.0 | WSR-301 | 5150 |
Характеристики cтарения состава:
Вязкость состава 1a после хранения в течение 125 дней при комнатной температуре оказалась равной 685 cP. При тех же условиях хранения вязкость состава 1e снизилась до 4450 cP. Основное падение вязкости происходило в течение первых 3 недель хранения.
Рецептура №2. Серная кислота с загустителем:
Компонент | вес. % |
Серная кислота (концентрация 98,0 вес. %) | 10,0 |
Водорастворимый полимер POLYOX® WSR N-3000 | 4,0 |
Вода (содержащая 0,128 г/л стабилизатора – двухлористого марганца) | 86,0 |
Методика приготовления:
В данной рецептуре иллюстрируется использование в качестве стабилизатора ионов металла вместо спирта, поэтому методика приготовления состава несколько иная. Сначала растворяют в воде двухлористый марганец, чтобы получить водный раствор, содержащий 0,0010 моля Mn++ (или 0,126 г MnCl2) в литре воды. В этом сильно разбавленном растворе двухлористого марганца тщательно диспергируют и растворяют полимер POLYOX.
Сначала растворяют в воде двухлористый марганец, чтобы получить водный раствор, содержащий 0,0010 моля Mn++ (или 0,126 г MnCl2) в литре воды. В этом сильно разбавленном растворе двухлористого марганца тщательно диспергируют и растворяют полимер POLYOX.
После полного растворения полимера POLYOX в смесь медленно и осторожно добавляют концентрированную серную кислоту. Смесь следует охлаждать и перемешивать – достаточно долго, чтобы кислота распределилась равномерно (приблизительно 5 минут).
Изменение вязкости состава при хранении:
Вязкость свежего состава, измеренная вискозиметром Cannon-Fenske (серия 500) со стеклянными капиллярами, равна 475 cSt. Через 50 дней вязкость состава уменьшилась до 397 cSt.
Рецептура № 3. Состав на основе хлористоводородной (соляной) кислоты с загустителем
Компонент | вес. % |
Соляная кислота | 10,0 |
Вода | 80,2 |
Водорастворимый полимер POLYOX® WSR N-301 | 2,0 |
Изопропиловый спирт | 7,8 |
Методика приготовления:
Сначала готовят суспензию полимера POLYOX в изопропиловом спирте, используя механическое перемешивание, чтобы улучшить смачивание. К перемешанной суспензии добавляют воду, и оставляют смесь на достаточное время (приблизительно один час), чтобы дать полимеру полностью раствориться. На заключительной стадии к водному раствору полимера осторожно прибавляют соляную кислоту. В зависимости от скорости добавления кислоты может потребоваться охлаждение смеси. При желании в качестве стабилизатора вязкости вместо изопропилового спирта или в сочетании с ним можно использовать систему тиомочевина/лимонная кислота, описанную в рецептуре №1.
К перемешанной суспензии добавляют воду, и оставляют смесь на достаточное время (приблизительно один час), чтобы дать полимеру полностью раствориться. На заключительной стадии к водному раствору полимера осторожно прибавляют соляную кислоту. В зависимости от скорости добавления кислоты может потребоваться охлаждение смеси. При желании в качестве стабилизатора вязкости вместо изопропилового спирта или в сочетании с ним можно использовать систему тиомочевина/лимонная кислота, описанную в рецептуре №1.
Исходная вязкость:
Вязкость свежего состава (21 000 cP) была определена на вискозиметре Брукфильда модели LVT с использованием насадки №3 при скорости 1,5 об/мин.
Рецептура № 4. Состав на основе лимонной кислоты с загустителем
Компонент | вес. % |
Лимонная кислота (моногидрат) | 3,0 |
Вода | 86,2 |
Водорастворимый полимер POLYOX® WSR N-3000 | 3,0 |
Изопропиловый спирт | 7,8 |
Методика приготовления:
Лимонную кислоту растворяют в воде. В отдельной емкости, достаточно большой, чтобы вместить весь состав, готовят суспензию полимера POLYOX в изопропиловом спирте, используя механическую мешалку. Суспензию перемешивают в течение 2-3 минут. После полного смачивания полимера изопропиловым спиртом в суспензию быстро вливают приготовленный водный раствор лимонной кислоты. Смесь перемешивают в течение 2 минут высокоскоростной мешалкой, чтобы однородно распределить полимер по всему объему раствора лимонной кислоты. По мере растворения загустителя вязкость раствора возрастает, и скорость перемешивания следует снизить до минимума, достаточного для предотвращения осаждения нерастворенного полимера на дно сосуда. Слабое перемешивание продолжают до полного растворения полимера POLYOX. Это занимает приблизительно от 60 до 90 минут.
В отдельной емкости, достаточно большой, чтобы вместить весь состав, готовят суспензию полимера POLYOX в изопропиловом спирте, используя механическую мешалку. Суспензию перемешивают в течение 2-3 минут. После полного смачивания полимера изопропиловым спиртом в суспензию быстро вливают приготовленный водный раствор лимонной кислоты. Смесь перемешивают в течение 2 минут высокоскоростной мешалкой, чтобы однородно распределить полимер по всему объему раствора лимонной кислоты. По мере растворения загустителя вязкость раствора возрастает, и скорость перемешивания следует снизить до минимума, достаточного для предотвращения осаждения нерастворенного полимера на дно сосуда. Слабое перемешивание продолжают до полного растворения полимера POLYOX. Это занимает приблизительно от 60 до 90 минут.
Изменение вязкости состава при хранении:
Вязкость свежего состава, измеренная вискозиметром Cannon-Fenske (серия 500) со стеклянными капиллярами, равна 460 cSt. Через 15 дней вязкость уменьшилась до 350 cSt.
Для приготовления составов с загустителями POLYOX можно использовать и гораздо более концентрированные растворы лимонной кислоты. Например, водный раствор моногидрата лимонной кислоты (с концентрацией 22 вес. %) можно сгустить до значения вязкости 1019 cSt, используя загуститель POLYOX WSR N-3000 (3,0% от веса смеси). Этот состав был приготовлен по методике, описанной для рецептуры №4, только часть воды была заменена моногидратом лимонной кислоты. Пример состава, содержащего частично нейтрализованную лимонную кислоту, приведен в рецептуре №5.
Рецептура № 5. Состав на основе лимоннокислого аммония с загустителем
Стадия 1. Готовится водный раствор лимонной кислоты (с концентрацией 3 вес. %) без загустителя, как определено и описано в методике для рецептуры №4. Этот раствор должен иметь pH от 2,0 до 2,4.
Стадия 2. Лимонную кислоту нейтрализуют аммиаком, доводя pH до значения 3,5. Это требует прибавления 2,27 г водного раствора аммиака (с концентрацией 28-30 вес. %) на каждые 10,0 г раствора моногидрата лимонной кислоты.
%) на каждые 10,0 г раствора моногидрата лимонной кислоты.
Стадия 3. Нейтрализованный раствор лимонной кислоты добавляют к суспензии полимера POLYOX в изопропиловом спирте. Можно воспользоваться методикой растворения и выбором загустителя, предложенными для рецептуры №1. При использовании в качестве загустителя POLYOX WSR N-3000 (3,0 вес. %) получен состав с исходной вязкостью 545 cSt, которая была измерена с помощью вискозиметра Cannon-Fenske (серия 500) со стеклянными капиллярами. Через 10 дней вязкость состава снизилась до 390 cSt.
Часто выгодно комбинировать две или несколько кислот в одном составе. Например, можно использовать одновременно лимонную и фосфорную кислоты, как показано в рецептуре №6.
Рецептура № 6. Состав на основе смеси лимонной и фосфорной кислот с загустителем
Компонент | вес. % |
Водорастворимый полимер POLYOX® WSR N-3000 | 2,5 |
Неионогенное поверхностно-активное вещество TERGITOL® 15-S-9 | 0,5 |
Фосфорная кислота | 3,0 |
Лимонная кислота | 4,0 |
Тиомочевина | 1,0 |
Динатриевая соль этилендиаминтетрауксусной кислоты (EDTA) | 1,0 |
Вода | 88,0 |
Методика приготовления:
EDTA и тиомочевину растворяют в воде. POLYOX WSR N-3000 всыпают в воронку, образуемую в быстро перемешиваемой воде. После полного растворения полимера в смесь добавляют лимонную кислоту, затем фосфорную кислоту, и, наконец, неионогенное поверхностно-активное вещество TERGITOL® 15-S-9.
POLYOX WSR N-3000 всыпают в воронку, образуемую в быстро перемешиваемой воде. После полного растворения полимера в смесь добавляют лимонную кислоту, затем фосфорную кислоту, и, наконец, неионогенное поверхностно-активное вещество TERGITOL® 15-S-9.
Изменение вязкости состава при хранении:
Исходная вязкость состава – 155 cP. После 330 дней хранения при комнатной температуре не произошло никаких изменений вязкости состава. Примерно после двух недель хранения на дно сосуда выпал белый кристаллический осадок EDTA.
Рецептура №7. Состав на основе щавелевой кислоты с загустителем
Компонент | вес. % |
Щавелевая кислота (дигират) | 0,63 |
Неионогенное поверхностно-активное вещество TERGITOL® 15-S-9 | 0,25 |
Тиомочевина | 0,03 |
Вода | 89,29 |
Водорастворимый полимер POLYOX® WSR-301 | 2,0 |
Изопропиловый спирт | 7,8 |
Методика приготовления:
Тщательно растворяют щавелевую кислоту в воде. Дальнейшая методика приготовления состава такая же, как для рецептуры №1.
Дальнейшая методика приготовления состава такая же, как для рецептуры №1.
Изменение вязкости состава при хранении:
Рецептура № 7 – типовая рецептура чистящих составов, очень часто используемых в промышленных целях: для очистки железнодорожных вагонов от ржавчины и т.д. Вязкость свежего состава (31 200 cP) была определена на вискозиметре Брукфильда модели LVT с использованием насадки №3 при скорости 1,5 об/мин. Через 10 дней вязкость состава снизилась до 27 200 cP.
Для приготовления составов с загустителями POLYOX можно успешно использовать и более концентрированные растворы щавелевой кислоты. 10-процентный (по весу) водный раствор дигидрата щавелевой кислоты является почти насыщенным раствором при комнатной температуре. Состав на основе этого раствора с добавлением загустителя POLYOX WSR-301 (2,0 вес. %) и изопропилового спирта (7,8 вес. %) имел вязкость 63 300 cP, измеренную методом, указанным выше для рецептуры №7.
Глюконовая кислота особенно эффективна для связывания в комплексы ионов алюминия. Она предотвращает или замедляет формирование налета окислов алюминия на стенках ванн для очистки металлов, которые используются для промывки металлических сборок, содержащих алюминиевые детали. Глюконовая или лимонная кислоты часто используются в сочетании с соляной кислотой, предотвращая образование нерастворимых гидроокисей железа. Типовая рецептура состава на основе глюконовой кислоты с загустителем приведена ниже.
Она предотвращает или замедляет формирование налета окислов алюминия на стенках ванн для очистки металлов, которые используются для промывки металлических сборок, содержащих алюминиевые детали. Глюконовая или лимонная кислоты часто используются в сочетании с соляной кислотой, предотвращая образование нерастворимых гидроокисей железа. Типовая рецептура состава на основе глюконовой кислоты с загустителем приведена ниже.
Рецептура №8. Состав на основе глюконовой кислоты с загустителем
Компонент | вес. % |
Глюконовая кислота | 5,0 |
Неионогенное поверхностно-активное вещество TERGITOL® 15-S-9 | 0,25 |
Вода | 84,95 |
Водорастворимый полимер POLYOX® WSR-301 | 2,0 |
Изопропиловый спирт | 7,8 |
Методика приготовления:
Методика приготовления состава такая же, как для рецептуры №1.
Изменение вязкости состава при хранении:
Вязкость свежего состава (33 000 cP) была определена на вискозиметре Брукфильда модели LVT с использованием насадки №3 при скорости 1,5 об/мин. За 20 дней вязкость состава не изменилась.
Рецептура №9. Состав на основе уксусной кислоты с загустителем
Компонент | вес. % |
Ледяная уксусная кислота | 50,0 |
Вода | 39,2 |
Водорастворимый полимер POLYOX® WSR N-3000 | 3,0 |
Изопропиловый спирт | 7,8 |
Методика приготовления:
Методика приготовления состава такая же, как для рецептуры №1.
Изменение вязкости состава при хранении:
Вязкость свежего состава, измеренная вискозиметром Cannon-Fenske (серия 500) со стеклянными капиллярами, равна 1150 cSt. Через 60 дней вязкость состава уменьшилась до 910 cSt.
Через 60 дней вязкость состава уменьшилась до 910 cSt.
Меры безопасности:
При намерении использовать любой продукт компании Dow Chemical потребители должны ознакомиться с нашими последними данными по безопасности и убедиться, что предполагаемое применение безопасно. Спецификации по безопасности и другие сведения, касающиеся безопасного обращения с химическими веществами, можно запросить в ближайшем региональном офисе продаж. Перед работой с любыми другими веществами, упомянутыми в тексте, потребители должны получить имеющиеся сведения по безопасному обращению с ними и предпринять все необходимые меры для гарантии безопасности.
Также Вы можете ознакомится с дополнительной информацией по водорастворимым полимерам серии POLYOX:
Водорастворимые полимеры POLYOX — Общие сведения.
Водорастворимые полимеры POLYOX — Применение.
Водорастворимые полимеры POLYOX — Свойства.
Водорастворимые полимеры POLYOX — Методики растворения.
Водорастворимые полимеры POLYOX — Загущение чистящих составов на основе кислот.
Для получения детальной консультации, пожалуйста, свяжитесь:
+38 050 3127173
Автор: Владимир Ионин
6 экомифов, которым не стоит верить
Экология – дело такое. Только думаешь, что все понял, во всем разобрался, а потом раз – и «интернет взорвала» новая информация. Для этой статьи мы попросили Елену Володину, журналиста и экоблогера, рассказать о популярных экомифах, с которыми она сталкивалась. Скажем прямо: большинство из них стало открытием и для нас.
Елена Володина
Миф 1. Сода, уксус и лимонная кислота – это экологично
Наверняка вы не раз встречали выражение «бытовая нехимия». Его активно используют и экоблогеры, и бренды, производящие экологичные средства по уходу за домом. Не хочется никого разочаровывать, но «бытовой нехимии» не существует, хотя бы потому, что химические процессы – это основа нашей жизни. Самыми популярными примерами «бытовой нехимии» обычно называют соду, уксус и лимонную кислоту. В книге «Жизнь замечательных веществ» (автор – Аркадий Курамшин) черным по белому написано, что все это – продукты многотоннажного химического производства.
Самыми популярными примерами «бытовой нехимии» обычно называют соду, уксус и лимонную кислоту. В книге «Жизнь замечательных веществ» (автор – Аркадий Курамшин) черным по белому написано, что все это – продукты многотоннажного химического производства.
Crema Joe © unsplash
Например, соду в России производят из поваренной соли, воды, аммиака и углекислого газа (продукт сжигания известняка). Вспомним скандал в Башкирии и историю горы Шахтау. Разработка началась в 1950-м году, и потребовалось менее 100 лет, чтобы от горы остался карьер. Она была уничтожена в ходе геологических работ по получению известняка Башкирской содовой компанией. Кстати, лимонную кислоту тоже получают не из лимонов, а синтезируют. Впрочем, еще неизвестно, что лучше: пустить под пресс тонну лимонов, чтобы получить из нее всего 25 кг лимонной кислоты и потом помыть ею раковину, – тоже не очень здоровая альтернатива. Да и вообще – лимоны нужны, чтобы их есть.
И что теперь делать:
Совсем не пользоваться содой, уксусом и лимонной кислотой – не вариант. Поэтому здесь главное – обойтись без фанатизма. Пользуйтесь всем, чем нужно, но не забывайте, какой ценой вам и планете это досталось. Обычно в этом и есть главная опасность термина «бытовая нехимия»: человек думает, что это экологично, и начинает транжирить средства направо и налево.
Поэтому здесь главное – обойтись без фанатизма. Пользуйтесь всем, чем нужно, но не забывайте, какой ценой вам и планете это досталось. Обычно в этом и есть главная опасность термина «бытовая нехимия»: человек думает, что это экологично, и начинает транжирить средства направо и налево.
Миф 2. Бисфенол А из чеков попадает в организм через кожу
Есть такая страшилка в интернете, что чеки нельзя долго держать в руках, потому что бисфенол А через кожу попадает в организм и вызывает необратимые гормональные изменения (так как по действию имитирует эстроген). Пару лет назад я решила провести небольшой эксперимент и нашла лабораторию в Москве, которая делает анализы на определение количества бисфенола А в организме. А чтобы можно было сравнить результаты, сдала сама и попросила сдать читательницу, которая постоянно работает с чеками на кассе.
В итоге у читательницы содержание бисфенола А оказалось меньше порога обнаружения. А у меня даже чуть больше референсного значения. На истину в последней инстанции не претендую, эксперимент был любительским, а не научным, но лично для меня он показал, что ужастики о бисфеноле в чеках всё же преувеличены. Не менее важно помнить: бисфенол А может содержаться не только в чеках, но и в изделиях из ПВХ и поликарбоната, а также в консервированных продуктах питания.
На истину в последней инстанции не претендую, эксперимент был любительским, а не научным, но лично для меня он показал, что ужастики о бисфеноле в чеках всё же преувеличены. Не менее важно помнить: бисфенол А может содержаться не только в чеках, но и в изделиях из ПВХ и поликарбоната, а также в консервированных продуктах питания.
И что теперь делать:
Подержать в руках чек – не самое страшное, что может с вами случиться. А от чеков имеет смысл отказаться не из-за бисфенола, а просто потому, что это не бумага, и их не сдать на переработку. Хорошо, что многие магазины переходят на электронные чеки (отправляются на e-mail) или же чеки сохраняются в приложении. В Москве это позволяют делать «Вкусвилл», «Перекресток», «Пятерочка» и «Азбука вкуса».
Миф 3. Бытовая химия в масс-маркете плохо биоразлагается
Большинство производителей экологичной бытовой химии своим продуктовым преимуществом называют высокую степень биоразложения средств. Однако мало кто знает, что это обязательный критерий для всех продуктов масс-маркета. В противном случае средства просто не смогли бы попасть на полки супермаркетов. Согласно требованиям к сырью по ГОСТ 32479-2013 и Регламенту N 648/2004 Европейского парламента и Совета Европейского союза «О детергентах», биоразлагаемость – это обязательный критерий для ВСЕХ типов ПАВ.
В противном случае средства просто не смогли бы попасть на полки супермаркетов. Согласно требованиям к сырью по ГОСТ 32479-2013 и Регламенту N 648/2004 Европейского парламента и Совета Европейского союза «О детергентах», биоразлагаемость – это обязательный критерий для ВСЕХ типов ПАВ.
«К обращению на рынке допускаются только те анионные, неионогенные, амфотерные, катионные ПАВ, первичная биоразлагаемость которых составляет не менее 80% по основному веществу, а полная – не менее 60% (по СО2) и не менее 70% по общему органическому углероду – в течение 28 дней». Для сравнения: моющие средства и средства для стирки BioMio, которые в 2019 году получили экосертификат Листок жизни, имеют «биоразлагаемость … более 60% за 28 дней, что подтверждено независимыми лабораторными испытаниями».
Еще один любопытный пример: линейка средств для мытья посуды Fairy Pure&Clean, которая недавно получила экосертификат «Листок жизни», на самом деле не изменила свой состав: продукция соответствовала всем экологическим критериям и до прохождения сертификации. Просто теперь бренд имеет право использовать соответствующий значок на своей упаковке. Надо понимать, что получение экосертификатов – удовольствие не дешевое, это длительный и затратный процесс, а главное – бизнес для сертифицирующих органов. Поэтому наличие сертификата хорошо, но его отсутствие также не означает, что средство не соответствует экологическим стандартам.
Просто теперь бренд имеет право использовать соответствующий значок на своей упаковке. Надо понимать, что получение экосертификатов – удовольствие не дешевое, это длительный и затратный процесс, а главное – бизнес для сертифицирующих органов. Поэтому наличие сертификата хорошо, но его отсутствие также не означает, что средство не соответствует экологическим стандартам.
И что теперь делать:
По возможности стараться покупать бытовую химию с экосертификатами (можно проверить в приложении ecolabel guide) и не демонизировать то, что сертификации не имеет.
Миф 4. Съедобная посуда – это экологично
Время от времени в интернете появляются восторженные новости о том, как какая-либо компания запустила съедобные кружки / тарелки (например, из яблочного пюре). Но не спешите радоваться: у этого решения недостатков больше, чем плюсов. Во-первых, такая посуда по-прежнему является одноразовой. Во-вторых, это решение плохо масштабируемо и хорошо лишь в качестве локального эксперимента. В-третьих, это непрактично. В-четвертых, не каждый готов, выпив чай, потом «закусить» съедобным стаканом. Особенно когда сам чай уже закончился. А еще это негигиенично. То есть сначала вы держали эту тарелку / стакан руками, ставили на стол и т. д., а потом будете есть? В желудке, конечно, соляная кислота, но стоит ли рисковать здоровьем ради экологии? Если очень хочется съесть «упаковку» или «тару», съешьте мороженое в вафельном стаканчике.
В-третьих, это непрактично. В-четвертых, не каждый готов, выпив чай, потом «закусить» съедобным стаканом. Особенно когда сам чай уже закончился. А еще это негигиенично. То есть сначала вы держали эту тарелку / стакан руками, ставили на стол и т. д., а потом будете есть? В желудке, конечно, соляная кислота, но стоит ли рисковать здоровьем ради экологии? Если очень хочется съесть «упаковку» или «тару», съешьте мороженое в вафельном стаканчике.
И что теперь делать:
Включать критическое мышление каждый раз, когда вам встречаются подобные новости. Помнить про иерархию обращения с отходами (перевернутая пирамида zerowaste, в основе которой – предотвращение образование отходов). Отказываться от одноразовой посуды в пользу многоразовой. Не лениться мыть тарелки и ложки.
Миф 5. Сдавать одежду на переработку – это ответственно
И да, и нет. Сдавать одежду на переработку лучше, чем выбрасывать на мусорный полигон, но сама по себе переработка не лучшее решение. Согласно пирамиде «ноль отходов», она находится лишь на четвертом месте по эффективности. Если вещь еще может кому-то послужить как вещь, то не надо скорее пытаться превратить ее в тряпки. Кстати, многие представляют, что переработка – это взять старую вещь и сделать из нее новую. К сожалению, это не так. Из старой футболки новую не сделаешь, переработка почти всегда осуществляется с понижением качества вещи (то есть не recycle, а downcycle). В большинстве случаев непригодную к повторной носке вещь просто нарезают на тряпки («обтирочная ветошь»).
Согласно пирамиде «ноль отходов», она находится лишь на четвертом месте по эффективности. Если вещь еще может кому-то послужить как вещь, то не надо скорее пытаться превратить ее в тряпки. Кстати, многие представляют, что переработка – это взять старую вещь и сделать из нее новую. К сожалению, это не так. Из старой футболки новую не сделаешь, переработка почти всегда осуществляется с понижением качества вещи (то есть не recycle, а downcycle). В большинстве случаев непригодную к повторной носке вещь просто нарезают на тряпки («обтирочная ветошь»).
И что теперь делать:
Не называть программы по утилизации вещей «переработкой». В идеале сначала вещи нужно отсортировать, затем все пригодное для повторной носки отправить в секонд-хенд или на благотворительность, и только потом – на переработку (нарезку ветоши и разволокнение). А еще осознавать, что, сдавая старые футболки / джинсы / свитера, вы не получаете индульгенцию, а с ней – право сразу же отправиться на шопинг. Мы производим так много вещей, что никогда в жизни не сможем их переработать. Лучшее, что можно сделать – сократить потребление.
Мы производим так много вещей, что никогда в жизни не сможем их переработать. Лучшее, что можно сделать – сократить потребление.
Миф 6. Бумажная трубочка или макаронина лучше пластиковой
Yulia Khlebnikova © unsplash
В 2021 году быть чем-то пластиковым стыдно, поэтому производители ищут альтернативы. Но не всегда замена получается экологичной. В данном случае потому, что соломинка изначально избыточна: пить напитки можно просто… ртом. Бумажная соломинка или пластиковая – это все равно одноразовая вещь (как и в случае со съедобной посудой). К сожалению, макаронина с большим диаметром ничем не лучше. То есть ресторан мог бы из таких макарон приготовить блюдо, а вместо этого вынужден отправлять еду на полигон.
И что теперь делать:
По возможности в общественных местах пить напитки без соломинок: заказывая латте, морс или лимонад, напомнить официанту, что трубочка вам не нужна. А в домашнем быту – так и быть – заменить их на металлические аналоги, которые вы сможете промывать специальным ершиком.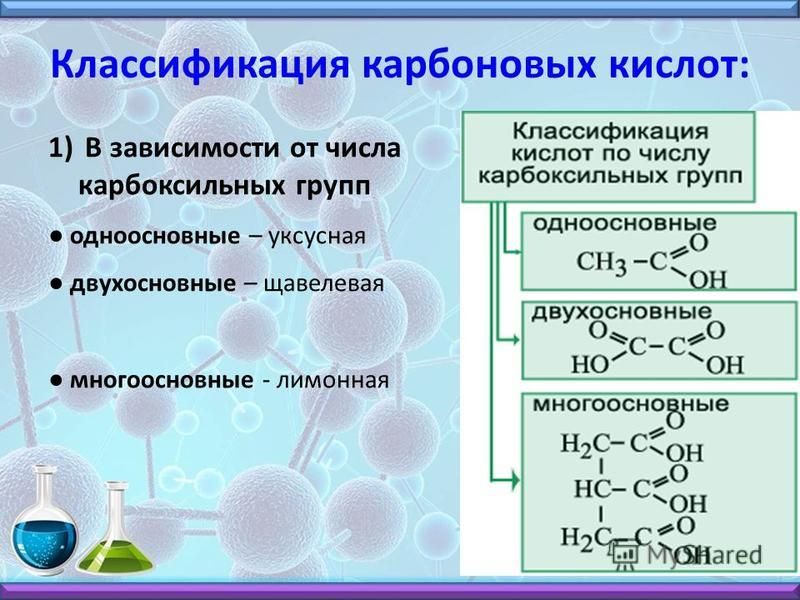
Резюме: будьте критичны, рассматривая те или иные экомифы, проявляйте любопытство и задавайте вопросы, проводите эксперименты, учитесь работать с ГОСТами и техническими регламентами (все они есть в открытом доступе).
Разница между уксусной кислотой и лимонной кислотой
Основное различие — уксусная кислота против лимонной кислоты
Уксусная кислота и лимонная кислота — два соединения, которые часто используются в качестве пищевых добавок. Поэтому эти составы встречаются на кухне; уксусная кислота содержится в уксусе, а лимонная кислота — в соке лайма. Основное различие между уксусной кислотой и лимонной кислотой состоит в том, что уксусная кислота является одноосновной кислотой, тогда как лимонная кислота является трехосновной кислотой.
Основные зоны покрытия
1.Что такое уксусная кислота
— Определение, свойства, применение
2. Что такое лимонная кислота
— Определение, свойства, применение
3. Сходства между уксусной кислотой и лимонной кислотой
Сходства между уксусной кислотой и лимонной кислотой
— Общие общие сведения Характеристики
4. Разница между уксусной кислотой и лимонной кислотой
— Сравнение основных различий
Ключевые термины: уксусная кислота, C 2 H 4 O 2 , CH 3 COOH, C 3 H 5 O (COOH) 3 , C 6 H 8 O 7 , лимонная кислота, этановая кислота, молекулярная формула, одноосновная кислота, трехосновная кислота, слабая кислота
Что такое уксусная кислота
Уксусная кислота также известна как этановая кислота.Он состоит из атомов C, H и O. Молекулярная формула уксусной кислоты: C 2 H 4 O 2 . Но наиболее распространенным способом представления уксусной кислоты является CH 3 COOH. Эта формула указывает некоторые подробности о структуре уксусной кислоты. Уксусная кислота — это карбоновая кислота. Он имеет только одну группу карбоновой кислоты. Он состоит из метильной группы (-CH 3 ), которая присоединена к атому углерода группы карбоновой кислоты. Молярная масса уксусной кислоты составляет около 60 г / моль.
Уксусная кислота — это карбоновая кислота. Он имеет только одну группу карбоновой кислоты. Он состоит из метильной группы (-CH 3 ), которая присоединена к атому углерода группы карбоновой кислоты. Молярная масса уксусной кислоты составляет около 60 г / моль.
Рисунок 01: Химическая структура уксусной кислоты
При комнатной температуре и давлении уксусная кислота представляет собой бесцветную жидкость с очень резким запахом. Температура кипения этой жидкости составляет около 118 o C. pK значение для этой кислоты составляет около 4,76. Следовательно, уксусная кислота является слабой кислотой и частично диссоциирует в воде. Но уксусная кислота смешивается с водой.
В водных растворах уксусная кислота диссоциирует, высвобождая атом водорода карбоксильной группы в виде иона H + .Это причина кислотности уксусной кислоты. Из-за наличия связи –O-H в карбоксильной группе уксусная кислота может иметь прочные водородные связи в твердой фазе.
Уксусная кислота может смешиваться как с полярными, так и с неполярными растворителями. Полярная группа уксусной кислоты представляет собой карбоксильную группу. Это вызывает смешивание уксусной кислоты с полярными растворителями. Метильная группа является неполярной группой и вызывает смешивание уксусной кислоты с неполярными растворителями.
Применение уксусной кислоты
- Производство уксуса
- Получение ацетатов металлов
- Растворители для смол
- Производство уксусного ангидрида
Что такое лимонная кислота
Лимонная кислота — это слабая кислота, наиболее часто встречающаяся в цитрусовых.Это трикарбоновая кислота с химической формулой C 6 H 8 O 7 . Обычный способ представления химической формулы лимонной кислоты: C 3 H 5 O (COOH) 3 . Это указывает на то, что лимонная кислота имеет три группы карбоновых кислот (-COOH). Кроме того, также присутствует гидроксильная группа (-ОН).
Кроме того, также присутствует гидроксильная группа (-ОН).
Молярная масса лимонной кислоты составляет около 192 г / моль. Это соединение без запаха. Лимонная кислота легко кристаллизуется из ее раствора.Эти кристаллы выглядят как белый порошок. Температура кипения лимонной кислоты составляет примерно 310 o C. Лимонная кислота смешивается с водой и безводным этанолом. Благодаря наличию карбоксильных групп лимонная кислота способна образовывать прочные водородные связи.
Рисунок 02: Химическая структура лимонной кислоты
Лимонная кислота — это трехосновная кислота. Он может выделять три протона (H + ) на молекулу. Следовательно, он имеет три значения pKa. pK a1 — 3.13, pK a2 составляет 4,76, а pK a3 составляет 6,40. Биологическая роль лимонной кислоты — это цикл лимонной кислоты; основной путь метаболизма животных и растений.
Применение лимонной кислоты
- Используется как пищевая добавка
- Используется как напиток
- Действовать как хелатирующий агент
- Состав некоторых косметических средств
Рисунок 03: Лимонная кислота используется при приготовлении еды и напитков
Сходства между уксусной кислотой и лимонной кислотой
- Уксусная кислота и лимонная кислота — слабые кислоты.

- Часто используются в качестве пищевых добавок.
Разница между уксусной кислотой и лимонной кислотой
Определение
Уксусная кислота: Уксусная кислота — полезная слабая кислота, которая содержится в основном в уксусе.
Лимонная Кислота: Лимонная кислота — слабая кислота, содержащаяся в цитрусовых.
Кислотность
Уксусная кислота: Уксусная кислота одноосновная (имеет один замещаемый атом водорода).
Лимонная Кислота: Лимонная кислота трехосновная (имеет три заменяемых атома водорода).
Молярная масса
Уксусная кислота: Молярная масса уксусной кислоты составляет около 60 г / моль.
Лимонная Кислота: Молярная масса лимонной кислоты составляет около 192 г / моль.
Химическая формула
Уксусная кислота: Химическая формула уксусной кислоты: CH 3 COOH.
Лимонная Кислота: Химическая формула лимонной кислоты: C 3 H 5 O (COOH) 3 .
Количество групп карбоновых кислот
Уксусная кислота: Уксусная кислота имеет только одну группу карбоновой кислоты.
Лимонная Кислота: Лимонная кислота имеет три группы карбоновых кислот.
Температура кипения
Уксусная кислота: Температура кипения уксусной кислоты составляет около 118 o ° C.
Лимонная Кислота: Температура кипения лимонной кислоты составляет примерно 310 o C.
pK
a
Уксусная кислота: Уксусная кислота имеет только одно значение pK и значение .
Лимонная Кислота: Лимонная кислота имеет три значения pK и .
Заключение
И уксусная, и лимонная кислоты являются очень полезными кислотными соединениями. Эти соединения вносят значительный вклад в небольшие приложения, а также в крупномасштабные отрасли промышленности. Основное различие между уксусной кислотой и лимонной кислотой заключается в том, что уксусная кислота является одноосновной кислотой, тогда как лимонная кислота является трехосновной кислотой.
Артикул:
1. ”Уксусная кислота (Ch4COOH).”Британская энциклопедия. Encyclopdia Britannica, inc., N.d. Интернет. Доступна здесь. 03 июля 2017.
2. «Что такое уксусная кислота». Study.com. Study.com, n.d. Интернет. Доступна здесь. 03 июля 2017.
Изображение предоставлено:
1. «Уксусная кислота-2D-плоский» Автор NEUROtiker — собственная работа (общественное достояние) через Commons Wikimedia
2. «Zitronensäure — лимонная кислота» Benjah-bmm27 — собственная работа (общественное достояние) через Commons Wikimedia
3. «Апельсины и апельсиновый сок», фото Скотта Бауэра, Министерство сельского хозяйства США. Номер изображения K7237-8.(Общественное достояние) через Commons Wikimedia
Сравнение влияния лимонной кислоты и уксусной кислоты в качестве имитатора кислых пищевых продуктов на выделение компонентов сплава из нержавеющей стали AISI 201
https://doi.org/10.1016/j.jfoodeng.2014.08.006Получить права и содержание
Основные моменты
- •
Исследован новый европейский тест для металлов и сплавов, контактирующих с пищевыми продуктами.
- •
0,3% лимонная кислота более агрессивна к AISI 201 по сравнению с 3% уксусной кислотой.
- •
Первоначальное высвобождение металла и пассивация поверхности из-за образования комплекса с цитратом металла.
- •
Выделение металла из нержавеющей стали AISI 201 ниже установленных пределов.
- •
Параметры испытаний для конкретного приложения сильно влияют на выделение металла.
Реферат
Для обеспечения безопасности металлов и сплавов, предназначенных для контакта с пищевыми продуктами, в 2013 году был опубликован новый европейский протокол испытаний (протокол CoE) с использованием лимонной кислоты в качестве имитатора пищевых продуктов.В этом исследовании изучалось влияние лимонной кислоты и условий воздействия на выделение металла из аустенитной марганцевой нержавеющей стали (AISI 201). Воздействие лимонной кислоты 5 г / л привело к значительно более низким выбросам металлов по сравнению с конкретными пределами выделения, установленными протоколом CoE. Лимонная кислота 5 г / л (0,3 об.%) Была более агрессивной, чем 3 об.% Уксусной кислоты (итальянский протокол) из-за более высокого комплексообразования с металлами. Исследования истираемых поверхностей показали, что большинство металлов высвободилось в первые 0.5 часов воздействия за счет пассивации поверхности. Истирание поверхности, повышенная температура (40–100 ° C), увеличенное соотношение площади поверхности к объему раствора (0,25–2 см 2 / мл) и повышенная концентрация лимонной кислоты (0–21 г / л) — все это привело к повышенному выделению металла. количества.
Ключевые слова
Аустенитная нержавеющая сталь
Контакт с пищевыми продуктами
Протокол CoE
Методические указания
Комплексообразование
Выделение металла
Поверхностный оксид
Рекомендуемые статьи Цитирующие статьи (0)
Авторские права © 2014 АвторыОпубликовано Elsevier Ltd.
Рекомендуемые статьи
Цитирующие статьи
Сравнение влияния лимонной кислоты и уксусной кислоты в качестве имитатора кислой пищи на выделение компонентов сплава из нержавеющей стали AISI 201
электрохимические свойства и выделение металла из распыленной Порошки из нержавеющей стали 316L
. Int. J. Electrochem. Sci. 7 (12), 11655–11677.
Хедберг, Ю., Одневалл Валлиндер, И., 2012. Исследования трансформации / растворения
выделения железа и хрома из частиц сплавов по сравнению с их чистыми металлами
и отдельными оксидами металлов.Матер. Коррос. 63 (6), 481–491.
Хедберг, Ю., Одневалл Валлиндер, И., 2014. Выделение металла и видообразование выделенного хрома
из биомедицинского сплава CoCrMo в смоделированные физиологически соответствующие растворы
. J. Biomed. Матер. Res. B Прил. Биоматер. 102 (4), 693–699.
Хертинг, Г., Одневалл Валлиндер, И., Лейграф, К., 2006. Факторы, влияющие на выделение металлов
из нержавеющих сталей, подвергающихся воздействию физиологических сред. Коррос.
Sci.48 (8), 2120–2132.
Хертинг, Г., Одневалл Валлиндер, И., Лейграф, К., 2008a. Вызванное коррозией выделение хрома и железа
из ферритной нержавеющей стали марки AISI 430 при контакте с имитацией пищевых продуктов
. J. Food Eng. 87 (2), 291–300.
Хертинг, Г., Одневалл Валлиндер, И., Лейграф, К., 2008b. Выделение в результате коррозии
основных легирующих компонентов марганцево-хромистых нержавеющих сталей в
различных средах. J. Environ. Монит. 10, 1084–1091.
ISSF, 2005. Стали «новой серии 200»: возможность или угроза для имиджа нержавеющей стали
?, PDF / ISSFNew200seriessteelsAnopportunityorathreat_EN.pdf>. Текст итальянского закона, 1973 г. Decreto Ministeriale 21/03/1973, гигиенические условия упаковки, тары и предметов, предназначенных для контакта с пищевыми продуктами или веществами, используемыми людьми. Дженсен, К.С., Лисби, С., Баадсгаард, О., Бириалсен, К., Менне, Т., 2003. Высвобождение ионов никеля из сплавов нержавеющей стали, используемых в стоматологических скобах, и их патч-тест реактивность в никель-чувствительных частные лица. Контактный дерматит 48 (6), 300–304. Камеруд, К.Л., Хобби, К.А., Андерсон, К.А., 2013. Нержавеющая сталь выщелачивает никель и хром в пищу во время приготовления. J. Agric. Food Chem. 61 (39), 9495–9501. Карими, С., Никчи, Т., Альфантази, А.М., 2012. Длительное исследование коррозии сплавов AISI 316L, Co – 28Cr – 6Mo и Ti – 6Al – 4V в растворах моделируемых тел. Заяв. Серфинг. Sci. 258 (16), 6087–6096. Коциян А., Милошев И., Пихлар Б., 2003. Влияние комплексообразователя и белков на коррозию нержавеющих сталей и их металлических компонентов. J. Mater. Sci. — Матер. Med. 14 (1), 69–77. Кремер Л.В., 2004. Усовершенствования пассивации с использованием рецептур лимонной кислоты, Конференция «Материалы и процессы для медицинских устройств».Asm Intl, 87–90. Кулиговски Дж., Гальперин К., 1992. Посуда из нержавеющей стали как важный источник никеля, хрома и железа. Arch. Environ. Contam. Toxicol. 23 (2), 211–215. Lambert, W.J., 1990. BUFCALC: программа для расчета буферов с заданным pH , ионной силой и буферной емкостью. J. Chem. Educ. 67 (2), 150. Lin, T.-I., Lee, Y.-H., Chen, Y.-C., 1993. Капиллярно-электрофоретический анализ неорганических катионов : роль комплексообразователя и буфера. pH.J. Chromatogr. A 654 (1), 167– 176. Ливингстон, E.H., 2004. Кто был студентом и почему мы так заботимся о его тесте t- ? J. Surg. Res. 118 (1), 58–65. Милошев И., 2002. Влияние комплексообразователей на электрохимическое поведение ортопедической нержавеющей стали в физиологическом растворе. J. Appl. Электрохим. 32 (3), 311–320. Невилл, А., Ходжкисс, Т., 1996. Оценка коррозионного поведения сплавов высокой марки в морской воде при повышенной температуре и при высокой скорости набегающего потока. .Коррос. Sci. 38 (6), 927–956. Окадзаки, Ю., Гото, Э., 2005. Сравнение высвобождения металлов из различных металлических биоматериалов in vitro. Биоматериалы 26 (1), 11–21. Olsson, C.-O.A., Landolt, D., 2003. Пассивные пленки на нержавеющих сталях — химия, структура и рост. Электрохим. Acta 48, 1093–1104. Пауэрс, округ Колумбия, Хиггс, А.Т., Обли, М.Л., Лебер, П.А., Гесс, К.Р., Йодер, К.Х., 2005. Анализ природных буферных систем и воздействия кислотных дождей.Экологический проект для студентов первого курса химии. J. Chem. Educ. 82 (2), 274. Седрикс, А.Дж., 1996. Коррозия нержавеющих сталей, второе изд. John Wiley & Sons Inc., Нью-Йорк. Simoneau, C., 2009. Руководство по условиям тестирования изделий, контактирующих с продуктами питания (с акцентом на кухонную утварь) — Публикация CRL-NRL-FCM, 1-е издание , 2009 г. Сообщества, Thyssen, J.P., Menne ´, T., 2010. Аллергия на металлы — обзор воздействия, проникновения, генетики, распространенности и клинических последствий. Chem. Res. Toxicol. 23 (2), 309– 318. Урбанский, E.T., Schock, M.R., 2000. Понимание, получение и вычисление емкости буфера . J. Chem. Educ. 77 (12), 1640. ВОЗ, 1996. Микроэлементы в питании и здоровье человека (Отчет о повторной оценке роли микроэлементов в здоровье и питании человека ), Программы.who.int/iris/bitstream/10665/37931/1/9241561734_eng.pdf>. World Организация здравоохранения, Женева, Швейцария. ВОЗ, 2011 г. Руководящие принципы по качеству питьевой воды, water_sanitation_health / Publications / 2011 / dwq_guidelines / en / index.html>, , четвертое издание. Всемирная организация здравоохранения. Виртанен, С., Милошев, И., Гомес-Баррена, Э., Требсе, Р., Сало, Дж., Конттинен, Ю.Т., 2008. Специальные режимы коррозии в физиологических и смоделированных физиологических условиях .Acta Biomater. 4, 468. Жанг, Ю., Каллай, Н., Матиевич, Э., 1985. Взаимодействие водных оксидов металлов с хелатирующими агентами . 7. Системы гематит-щавелевая и-лимонная кислота. Langmuir 1 (Copyright (C) Американское химическое общество (ACS), 2010. Все права защищены.), 201–206. Н. Мазинанян и др. / Journal of Food Engineering 145 (2015) 51–63 63 При разработке нашей 10-минутной рикотты мы исследовали причину и действие этих двух кислот; плюс наслаждайтесь этим сливочным сыром по четырем нашим любимым рецептам Ангус Фергюссон Создавать кремовый 10-минутный рассказ о рикотте для мартовского номера было очень весело, мы также многому научились в процессе.Приготовить рикотту очень просто и просто, если у вас есть точно подходящие ингредиенты. И, как только вы приготовили рикотту дома, вам больше никогда не захочется покупать ее в продуктовом магазине — домашняя версия — это , что хорошо . Что такое рикотта? Что мы узнали? В чем разница между лимонным соком и уксусом? Поскольку кислотность является катализатором коагуляции, мы можем только предположить, что этот немного более высокий уровень кислотности в уксусе заставил наши белки (твердые вещества молока) стать более твердыми, жесткими и сухими. Также существует вероятность того, что разные кислоты (уксусная или лимонная) по-разному реагируют с молоком. Наконец, нельзя не учитывать влияние аромата. Лимонный сок, казалось, производил прекрасный, мягкий, нежный аромат. Четыре способа использования рикотты: Первоначально опубликовано 15 февраля 2012 г. J Endourol.Авторская рукопись; доступно в PMC 2009, 9 февраля. Опубликован в окончательной редакции как: PMCID: PMC2637791 NIHMSID: NIHMS , MD, 1 , MD, 1, 2 , Ph.D. , 3 and, MD 3 1 Отделение хирургии, отделение урологии, Школа медицины и общественного здравоохранения Университета Висконсина, Мэдисон, Висконсин 1 Отделение хирургии, Отделение урологии, Школа медицины и общественного здравоохранения Висконсинского университета, Мэдисон, Висконсин 2 Отделение медицины, Школа медицины и общественного здравоохранения Университета Висконсина, Мэдисон, Висконсин 3 Отделение урологии Медицинской школы Университета Уэйк-Форест, Уинстон-Салем, Северная Каролина 3 Отделение урологии Медицинской школы Университета Уэйк-Форест, Уинстон-Салем, Север Каролина 1 Департамент хирургии, Отделение урологии, Школа медицины и общественного здравоохранения Университета Висконсина, Мэдисон, Висконсин 2 Департамент медицины, Школа медицины и общественного здравоохранения Университета Висконсина, Мэдисон, Висконсин 3 Отделение урологии, Медицинский факультет Университета Уэйк-Форест, Уинстон-Салем, Северная Каролина Запросы на перепечатку адресов: Kristina L.Пеннистон, доктор философии, научный сотрудник, Школа медицины и общественного здравоохранения Университета Висконсина, Департамент хирургии / Отделение урологии, 600 Highland Avenue, F4 / 320 Clinical Science Center, Madison, Wisconsin 53792-3236, электронная почта: ude.csiw.yregrus@nnep Окончательная отредактированная версия этой статьи издателем доступна на J Endourol. См. другие статьи в PMC, в которых цитируется опубликованная статья. Знания о содержании лимонной кислоты в напитках могут быть полезны в диетотерапии при кальциевой мочекаменной болезни, особенно среди пациентов с гипоцитратурией.Цитрат является естественным ингибитором кристаллизации мочи; Достижение терапевтической концентрации цитрата в моче является одной из клинических целей в лечении кальциевой мочекаменной болезни. В жидком виде напитки, содержащие лимонную кислоту, увеличивают общий объем мочи, снижая ее насыщение кальцием и другими кристаллами, и могут усилить выведение цитрата с мочой. Информация о содержании лимонной кислоты во фруктовых соках и коммерчески доступных рецептурах широко не известна.Мы оценили концентрацию лимонной кислоты в различных фруктовых соках. Содержание лимонной кислоты в 21 коммерчески доступном соке и концентрате сока, а также в соке трех видов фруктов было проанализировано с помощью ионной хроматографии. Лимонный сок и сок лайма являются богатыми источниками лимонной кислоты и содержат 1,44 и 1,38 г / унцию соответственно. Концентраты сока лимона и лайма содержат 1,10 и 1,06 г / унцию соответственно. Содержание лимонной кислоты в имеющихся в продаже лимонадах и других соковых продуктах широко варьируется от 0 до 0.03 до 0,22 г / унция. Сок лимона и лайма, как из свежих фруктов, так и из концентратов сока, содержит больше лимонной кислоты на литр, чем готовый к употреблению грейпфрутовый сок, готовый к употреблению апельсиновый сок и апельсиновый сок, выжатый из фруктов. . Готовые к употреблению составы лимонада и составы, требующие смешивания с водой, содержат в 6 раз больше лимонной кислоты в пересчете на унцию сока лимона и лайма. Лимонная кислота (2-гидрокси-1,2,3-пропантрикарбоксиловая кислота) представляет собой слабую трикарбоновую кислоту, которая естественным образом концентрируется в цитрусовых.При физиологическом pH крови и, в меньшей степени, в моче, он существует в основном в виде трехвалентного аниона. Лимонная кислота часто используется в качестве пищевой добавки для придания кислотности и кислого вкуса пищевым продуктам и напиткам. Цитратные соли различных металлов используются для доставки минералов в биологически доступных формах; примеры включают диетические добавки и лекарства. Среди фруктов лимонная кислота наиболее сконцентрирована в лимонах и лаймах, 1 , что составляет до 8% от веса сухих фруктов. Основной источник лимонной кислоты in vivo является результатом эндогенного метаболизма в митохондриях через производство АТФ в цикле лимонной кислоты.Желудочно-кишечная абсорбция лимонной кислоты из пищевых источников была связана с умеренным увеличением экскреции цитрата с мочой. 2 — 4 Цитрат мочи является мощным естественным ингибитором кристаллизации мочи. Цитрат свободно фильтруется в проксимальном канальце почки. Приблизительно от 10% до 35% цитрата с мочой выводится из организма; остальная часть всасывается по-разному, в зависимости от pH мочи и других внутрипочечных факторов. Цитрат — это самый распространенный органический ион, обнаруживаемый в моче.Гипоцитратурия, определяемая как <320 мг (1,67 ммоль) цитрата в моче / день, 5 является основным фактором риска кальциевой мочекаменной болезни. Считается, что активность цитрата связана с его концентрацией в моче, где он проявляет двойное действие, противодействуя образованию кристаллов с помощью как термодинамических, так и кинетических механизмов. Цитрат замедляет образование камней, подавляя процесс зародышеобразования оксалата кальция и рост камней как оксалата, так и фосфата кальция, в основном за счет его способности связываться с кальцием в моче и снижать концентрацию свободного кальция, тем самым уменьшая перенасыщение мочи.Цитрат связывается с поверхностью кристаллов оксалата кальция, подавляя рост и агрегацию кристаллов. 6 Также имеются данные о том, что цитрат блокирует адгезию кристаллов моногидрата оксалата кальция к почечным эпителиальным клеткам. 7 Медицинские вмешательства по увеличению содержания цитрата в моче являются основным направлением лечения мочекаменной болезни. 8 Сообщается, что количество цитрата пищевого происхождения, которое может избежать превращения in vivo в бикарбонат, является незначительным. 9 Тем не менее, в предыдущем исследовании сообщалось об увеличении содержания цитрата в моче после 1 недели приема 4 унций лимонного сока в день, разведенного в 2 л воды, у камнеобразователей с гипоцитратурией. 2 Два ретроспективных исследования показали влияние лимонного сока и / или потребления лимонада на цитрат мочи у кальциевых камней, 3 , 4 , но недавнее клиническое испытание не показало влияния лимонада на цитрат мочи. 10 База данных по питательным веществам Министерства сельского хозяйства США не предоставляет информации о содержании лимонной кислоты в пищевых продуктах.Хотя сообщалось о содержании лимонной кислоты в лимонном соке, 2 не существует опубликованной информации о содержании лимонной кислоты в коммерчески доступных напитках в США. быть клинически применимым для пациентов, которым требуется повышение или поддержание терапевтических концентраций цитрата в моче. Для измерения содержания цитрата в пищевых продуктах использовалось несколько методов, включая полярографическую, ферментативную и ионно-эксклюзионную хроматографию. 11 — 13 Эти методы подвержены помехам, могут быть относительно малочувствительными и трудоемкими. В последнее десятилетие ионная хроматография с использованием подавленной проводимости стала предпочтительным методом измерения органических кислот и других анионов в различных матрицах. 14 Мы использовали этот метод для измерения лимонной кислоты в различных фруктовых соках. Все продукты были получены из местных супермаркетов в Мэдисоне, Висконсине и Уинстон-Салеме, Северная Каролина, и включали свежие фрукты, готовые к употреблению фруктовые соки, концентраты сока лимона и лайма и кристаллизованные. составы лимонада.Приобретенные продукты перечислены в. Содержание лимонной кислоты в убывающем порядке различных фруктовых соков и имеющихся в продаже составов соков (граммы на литр) 7 7 7 Сок лайма, ReaLime 100% 2 10 0,6 60 4 2 6 1 1 1 Образцы готовых напитков и концентратов соков были взяты прямо из упаковки.Кристаллизованные составы лимонада смешивали с водой в соответствии с инструкциями на упаковке. Из свежих фруктов сок извлекался вручную. Для анализа образцы разбавляли водой на 1/5000. Анализ ионной хроматографии проводился на системе, состоящей из детектора проводимости Dionex ED50, ионообменной колонки Dionex AS11-HC 2 × 250 мм с защитной колонкой при контролируемой температуре 30 ° C и Dionex. 2-мм глушитель ASRS-ULTRA (Dionex Corporation, Саннивейл, Калифорния). Использовали градиент от 20 до 35 мМ гидроксида натрия в течение 10 минут; цитрат элюируется через 7,6 мин. Площади пиков соотносились с площадями стандартной кривой для количественного определения концентрации лимонной кислоты. Мы сравнили концентрации лимонной кислоты в группах соков и соковых продуктов с помощью дисперсионного анализа (ANOVA). Попарные сравнения проводились с использованием защищенных критериев наименьшего значимого различия Фишера. P -значения <0,05 считались значимыми. Все анализы были выполнены с использованием статистического программного обеспечения SAS (SAS Institute Inc., Кэри, Северная Каролина). Содержание лимонной кислоты в различных фруктовых соках и фруктовых напитках указано в. Сравнение содержания лимонной кислоты в соках и напитках по группам показано на. Сок лимонов и лаймов, выжатый из плодов, содержал больше всего лимонной кислоты (48 и 46 г / л соответственно). Не было разницы между соком лимона и лайма по содержанию лимонной кислоты ( P = 0.35). Лимонный сок и сок лайма из концентрата были одинаковыми по содержанию лимонной кислоты (34–39 г / л). Грейпфрутовый сок и апельсиновый сок из готовых к употреблению 100% соков содержали 25 и 17 г / л соответственно. Не было разницы между составом обычного апельсинового сока и его «легким» аналогом. Апельсиновый сок, выжатый непосредственно из апельсинов, имел более низкое содержание лимонной кислоты, чем апельсиновый сок, готовый к употреблению ( P = 0,003). Из имеющихся в продаже составов лимонада и лаймада, которые обычно содержат 15% настоящего сока или меньше, готовые к употреблению содержат больше лимонной кислоты, чем порошкообразные смеси, которые были приготовлены путем смешивания с водой в соответствии с инструкциями на упаковке. ( P = 0.03). Не было разницы между легкими и не содержащими сахара готовыми к употреблению лимонадами и их обычными аналогами ( P = 0,76), а также не было разницы между легкими и не содержащими сахара лимонадами и кристаллизованными порошкообразными лимонадными смесями ( P ). = 0,21). Сравнение концентраций лимонной кислоты (г / унция) в соках и соковых продуктах по группам. Полоски, где показано, представляют SD для каждой группы. Значения над каждой полосой — это среднее содержание лимонной кислоты (г / унция) на группу. Группы с одинаковыми буквами похожи ( p > 0.03). RTC, готовый к употреблению; рег, обычный. Медицинское лечение кальциевой мочекаменной болезни зависит от манипулирования балансом кристаллических промоторов и ингибиторов. Нутритивная терапия, направленная на индивидуальные факторы риска пациента, является основной стратегией профилактики камней в почках и подходящим дополнением к фармакологической терапии. Краеугольным камнем профилактики является достижение соответствующего разведения мочи за счет увеличения объема мочи. Это снижает перенасыщение мочи, что является необходимым первым шагом в образовании кристаллов. Второй целью предотвращения образования кальциевых камней является повышение концентрации ингибиторов кристаллов. Из них цитрат является наиболее клинически значимым, поскольку на него можно воздействовать либо диетой, либо фармакологической терапией, либо их комбинацией. В то время как 320 мг (1,67 ммоль) цитрата мочи в 24-часовом сборе мочи считается пороговым значением для определения гипоцитратурии, 5 некоторые клиницисты нацелены на 24-часовую концентрацию цитрата в моче ≥600 мг (3,12 ммоль), что составляет ближе к выделению цитрата с мочой у здоровых людей, не образующих камней. 15 Гипоцитратурия, если она тяжелая и / или стойкая, обычно требует фармакологической терапии в виде цитрата калия, который увеличивает pH мочи, а также выведение цитрата. Идентификация и стимулирование потребления жидкостей, которые увеличивают потенциал мочи по ингибированию кристаллов, являются привлекательными не только для стимулирования потребления жидкости, но и для улучшения выведения цитрата с мочой. Лимонная кислота — это встречающаяся в природе органическая кислота, содержащаяся во многих фруктах и их соках. Таким образом, данные о содержании лимонной кислоты в свежих фруктовых соках и имеющихся в продаже напитках из фруктовых соков могут оказаться полезными при составлении схем лечебного питания для лиц, образующих кальциевые камни. Лимон и сок лайма, как из свежих фруктов, так и из концентратов сока, содержат больше лимонной кислоты на литр, чем готовый к употреблению грейпфрутовый сок, готовый к употреблению апельсиновый сок и апельсиновый сок, выжатый из фруктов. Эти данные совпадают с ранее сообщенными. 2 Поскольку сок лимона и лайма содержат 38 и 35 мг калия на унцию соответственно, примерно столько же, сколько грейпфрутовый сок и около 60% апельсинового сока (содержание калия получено из Министерства сельского хозяйства США, Служба сельскохозяйственных исследований, Национальная служба Министерства сельского хозяйства США). База данных по питательным веществам для стандартной справки, выпуск 19, домашняя страница лаборатории данных по питательным веществам: http: // www.ars.usda.gov/main/site_main.htm?modecode=12354500, по состоянию на 02.07.2007), ежедневное употребление сока лимона или лайма может обеспечить пищевую щелочность, которая уменьшит реабсорбцию цитрата в канальцах, что приведет к усилению выведение цитрата с мочой. Распределение сока лимона или лайма в большом количестве воды или другой жидкости, потребляемой в течение дня, также увеличивает объем потребляемой жидкости, что приводит к увеличению диуреза 4 и снижению перенасыщения мочи. Дальнейшие исследования должны определить биодоступность диетической лимонной кислоты из различных источников и охарактеризовать реакцию на диетическую лимонную кислоту у лиц с гипоцитратурией и нормоцитратурией.Влияние полученного с пищей цитрата на концентрацию в моче у лиц, образующих кальциевые камни, потребляющих различные диеты (например, высокое потребление фруктов / овощей v низкое потребление фруктов / овощей; высокое потребление мяса v низкое потребление мяса) следует оценивать как диетическое. Известно, что закономерности влияют на концентрацию цитрата в моче. 9 1. Muller M, Irkens-Kiesecker U, Rubinstein B, et al. О механизме перекисления лимона: Сравнение активности вакуолярной H (+) — АТФазы плодов и эпикотилей.J Biol Chem. 1996; 271: 1916. [PubMed] [Google Scholar] 2. Зельцер М.А., Лоу Р.К., Макдональд М. и др. Диетические манипуляции с лимонадом для лечения гипоцитратурического кальциевого нефролитиаза. J Urol. 1996; 156: 907. [PubMed] [Google Scholar] 3. Канг Д., Халеблиан Г.Е., Сур Р.Л. и др. Длительные диетические манипуляции на основе лимонада у пациентов с гипоцитратурическим нефролитиазом. J Urol. 2007; 177: 1358. [PubMed] [Google Scholar] 4. Пеннистон KL, Стил TH, Накада SY. Лимонадная терапия увеличивает объем цитрата и мочи в моче у пациентов с рецидивирующими камнями из оксалата кальция.Урология. 2007; 70: 856. [PubMed] [Google Scholar] 5. Пак CYC. Цитратные и почечные камни: обновленная информация. Miner Electrolyte Metab. 1994; 20: 371. [PubMed] [Google Scholar] 6. Ryall RL. Ингибиторы кристаллизации оксалата кальция в моче и их потенциальная роль в камнеобразовании. Мир Дж Урол. 1997; 15: 155. [PubMed] [Google Scholar] 7. Шенг X, Юнг Т., Вессон Дж. А. и др. Адгезия к поверхности кристаллов оксалата кальция и влияние компонентов мочи. Proc Natl Acad Sci USA. 2005; 102: 267. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Гейльберг И.П. Обновленная информация о диетических рекомендациях и лечении почечно-каменной болезни. Пересадка нефрола Dial. 2000; 15: 117. [PubMed] [Google Scholar] 9. Meschi T, Maggiore U, Fiaccadori E, et al. Влияние фруктов и овощей на факторы риска мочевых камней. Kidney Int. 2004; 66: 2402. [PubMed] [Google Scholar] 10. Одвина CV. Сравнительная ценность апельсинового сока и лимонада в снижении риска камнеобразования. Clin J Am Soc Nephrol. 2006; 1: 1269. [PubMed] [Google Scholar] 11. Перес А.С., Мендес Дж. Х., Барез Я.Г.Полярографическое и спектрофотометрическое определение цитрата в коммерческих апельсиновых и лимонных напитках. Food Chem. 1989; 32: 69. [Google Scholar] 12. Моллеринг Х., Грубер Х. Определение цитрата цитратлиазой. Анальная биохимия. 1966; 17: 369. [PubMed] [Google Scholar] 13. Чинничи Ф., Спинабелли У., Рипони С. и др. Оптимизация определения органических кислот и сахаров во фруктовых соках методом ионно-эксклюзионной жидкостной хроматографии. J Food Compost Anal. 2005; 18: 121. [Google Scholar] 14. Сингх Р.П., Смешко С.А., Аббас Н.М.Ионно-хроматографическая характеристика токсичных растворов: Анализ и ионная химия биологических жидкостей. J Chromatogr A. 1997; 774: 21. [PubMed] [Google Scholar] Адольф, М. и Паули, В., 1924. Biochem. Zeitschr., Bd. 152, С. 360. Google ученый Беккер, З. Э., 1933. Microbiology, vol. 3, № 4, с. 160 с. Google ученый -, 1934. Ботан. Journ. СССР (отпечатано на русском языке). Брукс, М., 1923. U. S. Pub. Health Repts., № 846, с. 1470. Google ученый -, 1923. Proc. Soc. Exp. Биол. и Med., т. 20, стр. 384. Google ученый Брухатова, А., 1928. Акты Звенигородской гидрофизической станции. Институт экспериментальной биологии, Москва, с. 124 с. Google ученый Chambers, R., 1922. Journ. Gen. Physiol., Т. 5, стр. 189. Google ученый -, 1928. Biol. Булл., Т. 55, стр. 369. Google ученый — andPollack, H., 1927. Journ. Gen. Physiol., Т. 10, стр. 739. Google ученый Чейз, А. М., Глазер, О., 1930. Journ. Gen. Physiol., Т. 13, стр. 627. Google ученый Клоуз, Г. Х. А., Смит, Х. У., 1923. Amer. Journ. Physiol., Т. 64, стр. 144. Google ученый Колландер, Р., Turpeinen, O. undFabritius, E., 1931. Protoplasma, Bd. 13, С. 348. Google ученый Crosier, W., 1916. Journ. Биолог. Chem., Vol. 24, стр. 255. Google ученый -, 1916. Journ. Биол. Chem., Vol. 26, стр. 217. Google ученый Фрейзер, Л., Мак. Ph., 1925. Амер. Journ.Physiol., Т. 72, стр. 119. Google ученый Галагев, М. А., Мальм, Э. Н., 1932. Memoire of Acad. наук СССР, сер. 7, № 1. Gicklhorn, J. U. Keller, R., 1926. Zeitschr. f. благоразумие. Zoolog., Bd. 127, с. 244. Google ученый Гомпель, М., 1925. Ann. de Physiol. et Physicochemie Biol., vol. 1, стр.166. Google ученый Гуцрейн, М., 1932. Protoplasma, Bd. 17, с. 454. Google ученый Харви, Н., 1911. Journ. Exper. Зоол., Т. 10, стр. 507. Google ученый -, 1915. Int. Zeitschr. f. физ.-хим. Biol., Bd. 1, С. 463. Google ученый Haywood, C., 1925. Journ. Gen. Physiol., Т. 7, стр. 693. Google ученый Джейкобс, М. Х., 1912. Journ. Exper, Zool., Vol. 12, стр. 519. Google ученый -, 1920. Амери. Journ. Physiol., Т. 51, стр. 321. Google ученый -, 1920. Амери. Journ. Physiol., Т.53, стр. 457. Google ученый -, 1922. Journ. Gen. Physiol., Т. 5, стр. 181. Google ученый -, 1922. Биол. Булл., Т. 42, стр. 14. Google ученый Жак А. Г. и Остерхаут В. И. В., 1930. Journ. Gen. Physiol., Т. 13, стр. 625. Google ученый Krogh, 1919. Journ. Physiol., vol. 52, стр. 391. Google ученый Loeb, J., 1906. Arch. f. d. Gesamm. Physiol., Bd. 115, с. 564. Google ученый Loeb, L. и Gilman, F., 1914. Amer. Journ. Physiol., Т. 67, стр. 526. Google ученый Лоприоре, Г., 1895.Jahrb. f. благоразумие. Бот., Корп. 28, С. 531. Google ученый Лосина-Лосинский, Л. К., 1926. Воспоминания ученого Лесгафта. Inst., Т. 11, стр. 57 с. Google ученый Мальм Э. Н., 1930. Акты Севастопольской биол. Станция., Т. 2 с. Никитинский, Дж., 1928. Zentralbl. f. Бактер., II. Abt., Bd. 73. — undMudrezowa-Wyss, Fr. К., 1930. Zentralbl. f. Bakt., Abt. II, Bd. 81. Остерхаут, В. И. В. и Доркас, 1925. Journ. Gen. Physiol., Т. 9, стр. 255. Google ученый Пантин, К. Ф. А., 1923. Nature, vol. 111, стр. 81. Google ученый Пирс, Х. Э., 1925. Arch. Int. Med., Bd. 35, С. 347. Google ученый Pfeiffer, H., 1927. Protoplasma, Bd. 1, с. 434. Google ученый Pollack, H., 1928. Biol. Булл., Т. 55, стр. 383. Google ученый Рейсс, П., 1926. «Внутренний рН целлюлозы». Париж. Резникофф П. и Чемберс Р., 1927. Journ. Gen. Physiol., Т. 10, стр. 731. Google ученый — andPollack, H., 1928. Biol. Булл., Т. 55, стр. 377. Google ученый Румянцев, А. и Кедровский, Б., 1927. Protoplasma, Bd. 1, С. 189. Google ученый Schaede, R., 1923. Ber. d. Deutsch. Бот. Ges., Bd. 41, с. 345. Google ученый Шмидтманн, М., 1924.Biochem. Zeitschr., Bd. 150, С. 253. Google ученый Sierakowski, S. und Zajdel, R., 1924. Biochem. Zeitschr., Bd. 152, с. 111. Google ученый Смолл, Дж., 1929. «Концентрация ионов водорода в растительных клетках и тканях». Protoplasma-Monographien. II. Берлин. Смит, 1926. Amer. Journ. Physiol., vol. 76, стр.411. Google ученый Смит, Х. У. и Клоуз, Г. Х. А., 1924. Amer. Journ. Physiol., Т. 68, стр. 183. Google ученый Смит, Э. П., 1923. Nature, vol. 112, стр. 654. Google ученый -, 1933. Protoplasma, Bd. 18, С. 90. Google ученый Spek, J. undChambers, R., 1933. Protoplasma, Bd. 20, С. 376. Google ученый Thiel undStrohecker, 1914. Ber., Bd. 47, С. 945. Google ученый Vlès, F., 1925. Arch. физ. Биол., Т. 4, стр. 228. Google ученый Верли-Хегнер, Дж. Унд Висс, О. А. М., 1933.Biochem. Zeitschr., Bd. 266, С. 46. Google ученый Winterstein, 1919. «Die Narkose in ihrer Bedeutung für die allgemeine Physiologie». Берлин. Wulff, P., 1926. Chemikerzeitung, Bd. 50, С. 732. Google ученый -, 1926. Kolloid-Zeitschrift, Bd. 40, № 4. Захарова Т. М., 1925.Jahrb. f. благоразумие. Бот., Корп. 65, С. 61. Google ученый Speyer & Grund GmbH & Co. KG, Smartcon GmbH. Marktforschung Essignutzung. 2018. Google ученый Скотт Э., Блумфилд С.Ф., Барлоу К.Г.Исследование микробного заражения в доме. Дж. Хиг (Лондон). 1982. 89 (2): 279–93. CAS Google ученый Скотт Э., Дьюти С., МакКью К. Критическая оценка метициллин-резистентного золотистого стафилококка и других бактерий, представляющих медицинский интерес, на часто затрагиваемых поверхностях в домашнем хозяйстве с точки зрения демографии домохозяйства. Am J Infect Control. 2009. 37 (6): 447–53. PubMed Google ученый Скотт Э. Инфекции в общинах и потенциальная роль обычных сенсорных поверхностей как переносчиков инфекционных агентов в домашних условиях и в общественных местах. Am J Infect Control. 2013. 41 (11): 1087–92. PubMed Google ученый Русин П., Орос-Кафлин П., Герба С. Уменьшение количества фекальных колиформных, колиформных и гетеротрофных бактерий на кухне и в ванной комнате путем дезинфекции с помощью чистящих средств с гипохлоритом.J Appl Microbiol. 1998. 85 (5): 819–28. CAS Google ученый Nix ID, Frontzek A, Bockmühl D. Характеристика микробных сообществ в бытовых стиральных машинах. Tenside Surfactant Deterg. 2015; 52 (6): 432–40. CAS Google ученый Блумфилд С.Ф., Экснер М., Синьорелли С., Скотт Э.А. Эффективность процессов отмывания, используемых в домашних (домашних) условиях.В: Международный научный форум по домашней гигиене; 2013. Google ученый Донски CJ. Уменьшает ли улучшение очистки и дезинфекции поверхностей число инфекций, связанных с оказанием медицинской помощи? Am J Infect Control. 2013; 41 (5 доп.): S12–9. PubMed Google ученый Кларк Дж., Оукс Л., Миллер Л., Хиндли П., МакГичан П., Петков Дж. И др. К методу испытаний эффективности в лабораторных условиях для оценки гигиенических дезинфицирующих средств для стирки на стадии ополаскивания.Tenside Surfactant Deterg. 2018; 55 (5): 410–6. CAS Google ученый Рутала, Вашингтон, Барби С.Л., Агиар, Северная Каролина, Собси, доктор медицины, Вебер Д. Антимикробная активность домашних дезинфицирующих средств и натуральных продуктов в отношении потенциальных патогенов человека. Инфекционный контроль Hosp Epidemiol. 2013. 21 (3): 33–8. Google ученый Ricke SC. Перспективы использования органических кислот и короткоцепочечных жирных кислот в качестве противомикробных средств.Poult Sci. 2003. 82 (4): 632–9. CAS Google ученый Мани-Лопес Э., Гарсия Х.С., Лопес-Мало А. Органические кислоты как противомикробные средства для борьбы с сальмонеллами в мясе и продуктах из птицы. Food Res Int. 2012. 45 (2): 713–21. Google ученый Макино С.И., Чеун Х.И., Табучи Х., Сирахата Т. Антибактериальная активность половы уксуса и его практическое применение.J Vet Med Sci. 2000. 62 (8): 893–5. CAS Google ученый Сенгун И.Ю., Карапинар М. Эффективность лимонного сока, уксуса и их смеси в элиминации Salmonella typhimurium на моркови (Daucus carota L.). Int J Food Microbiol. 2004. 96 (3): 301–5. CAS Google ученый Сенгун И.Ю., Карапинар М. Эффективность домашних натуральных дезинфицирующих средств в устранении Salmonella typhimurium на ракете (Eruca sativa Miller) и зеленом луке (Allium cepa L.). Int J Food Microbiol. 2005. 98 (3): 319–23. Google ученый Фредерик Т., Миллер М., Томпсон Л., Рэмси С. Микробиологические свойства мяса свиной щеки под влиянием уксусной кислоты и температуры. J Food Sci. 1994. 59 (2): 300–2. CAS Google ученый Beuchat LR, Ryu JH, Adler BB, Harrison MD. Смерть Salmonella, Escherichia coli O157: H7 и listeria monocytogenes в жидких заправках для салатов на молочной основе длительного хранения.J Food Prot. 2006. 69 (4): 801–14. PubMed Google ученый Брэдли Е.М., Уильямс Дж.Б., Шиллинг М.В., Коггинс П.С., Крист С., Йодер С. и др. Влияние производных лактата натрия и уксусной кислоты на качество и органолептические характеристики котлет из свиной колбасы на горячих костях. Meat Sci. 2011. 88 (1): 145–50. CAS Google ученый Siebenga JJ, Vennema H, Duizer E, Koopmans MPG.Гастроэнтерит, вызванный норовирусом GGII.4, Нидерланды, 1994-2005 гг. Emerg Infect Dis. 2007. 13 (1): 144–6. PubMed Google ученый Нода М., Фукуда С., Нишио О. Статистический анализ уровня атак при вспышках болезней пищевого происхождения. Int J Food Microbiol. 2008. 122 (1–2): 216–20. PubMed Google ученый Bodewes R, Morick D, de Mutsert G, Osinga N, Bestebroer T., van der Vliet S, et al.Повторяющиеся инфекции, вызванные вирусом гриппа B, у тюленей. Emerg Infect Dis. 2013; 19 (3): 511–2. PubMed Google ученый Городская комиссия здравоохранения Ухани. Отчет о текущей ситуации с пневмонией в Ухане (2019-12-31). 2020. Доступно по адресу: http://wjw.wuhan.gov.cn/front/web/showDetail/201 08989 [цитируется 14 апреля 2020 г.]. Google ученый Кирквуд CD, Епископ РФ. Молекулярное обнаружение калицивируса человека у маленьких детей, госпитализированных с острым гастроэнтеритом в Мельбурне, Австралия, в 1999 году. J Clin Microbiol. 2001. 39 (7): 2722–4. CAS Google ученый Karst SM, Wobus CE, Lay M, Davidson J, Virgin HW IV. STAT1-зависимый врожденный иммунитет к норвалькоподобному вирусу. Наука (80-). 2003. 299 (5612): 1575–8. CAS Google ученый Wobus CE, Karst SM, Thackray LB, Chang KO, Сосновцев SV, Belliot G, et al. Репликация норовируса в культуре клеток обнаруживает тропизм для дендритных клеток и макрофагов. PLoS Biol. 2004; 2 (12): e432. Duizer E, Schwab KJ, Neill FH, Atmar RL, Koopmans MPG, Estes MK. Лабораторные попытки культивирования норовирусов. J Gen Virol. 2004. 85 (1): 79–87. CAS Google ученый Кингсли Д.Х., Холлиман Д.Р., Кальчи К.Р., Чен Х., Флик Г.Дж.Инактивация норовируса обработкой под высоким давлением. Appl Environ Microbiol. 2007. 73 (2): 581–5. CAS Google ученый Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. Новый коронавирус от пациентов с пневмонией в Китае, 2019. N Engl J Med. 2020; 382 (8): 727–33. CAS Google ученый Goodyear N, Brouillette N, Tenaglia K, Gore R, Marshall J. Эффективность трех домашних средств для очистки и дезинфекции Staphylococcus aureus и Escherichia coli на поверхностях в домашних условиях. J Appl Microbiol. 2015; 119 (5): 1245–52. CAS Google ученый Килонзо-Нтенге А, Чен ФК, Годвин С.Л. Эффективность домашних методов мойки в контроле поверхностного микробного загрязнения свежих продуктов.J Food Prot. 2006. 69 (2): 330–4. PubMed Google ученый Deutsches Institut für Normung e. V. DIN EN 1040 — Chemische Desinfektionsmittel und Antiseptika — Quantitativer Suspensionversuch zur Bestimmung der bakteriziden Wirkung (Basistest) chemischer Desinfektionsmittel und Antiseptika — Prüfverfahren und Anforderungen (Фаза 1). 2006 ;. Google ученый Deutsches Institut für Normung e. V. DIN EN 1275 Chemische Desinfektionsmittel und Antiseptika — Quantitativer Suspensionversuch zur Bestimmung der фунгизид или левурозиден Wirkung (Basistest) chemischer Desinfektionsmittel und Antiseptika — Prüfverfahren und Anforderungen (Phase1). 2006. Google ученый Deutsches Institut für Normung e. V. DIN EN 13697 Chemische Desinfektionsmittel und Antiseptika — Quantitativer Oberflächen-Versuch nicht poröser Oberflächen zur Bestimmung der bakteriziden und / oder фунгизид Wirkung chemischer Desinfektionsmittel in den Bereichen Lebensmittel, H.2015. Google ученый Schages J, Stamminger R, Bockmühl D. Новый метод оценки антимикробной эффективности бытовых моющих средств для стирки. J Surfactant Deterg. 2020; 23 (3): 629–639. Deutsches Institut für Normung e. V. DIN EN 14476 — Chemische Desinfektionsmittel und Antiseptika — Quantitativer Suspensionsversuch zur Bestimmung der viruziden Wirkung im humanmedizinischen Bereich — Prüfverfahren und Anforderungen (Phase 2, Stufe 1).2019. Google ученый Deutsches Institut für Normung e. V. DIN EN 16777 Chemische Desinfektionsmittel und Antiseptika — Quantitativer Versuch auf nicht porösen Oberflächen ohne Mechanische Einwirkung zur Bestimmung der viruziden Wirkung im humanmedizinischen Bereich — Prüfverfahren und Anforderungen (Phase 2). 2019. Google ученый Kilonzo-Nthenge A, Liu S.Противомикробная эффективность бытовых дезинфицирующих средств против искусственно инокулированной сальмонеллы на готовом к употреблению шпинате (Spinacia oleracea). J fur Verbraucherschutz Leb. 2019; 14 (2): 105–12. CAS Google ученый Комияма Е.Ю., Бэк-Брито Г.Н., Бальдуччи И., Кога-Ито К.Ю. Оценка альтернативных методов дезинфекции зубных щеток. Braz Oral Res. 2010. 24 (1): 28–33. PubMed Google ученый Medina E, Romero C, Brenes M, De Castro A. Противомикробная активность оливкового масла, уксуса и различных напитков против патогенов пищевого происхождения. J Food Prot. 2007. 70 (5): 1194–9. CAS Google ученый Gopal J, Anthonydhason V, Muthu M, Gansukh E, Jung S, Chul S, et al. Подтверждение заявлений о домашних средствах яблочного уксуса: антибактериальные, противогрибковые, противовирусные свойства и аспект цитотоксичности. Nat Prod Res.2017; 33 (6): 906–10. PubMed Google ученый Энтани Э, Асаи М., Цуджихата С., Цукамото Ю., Охта М. Антибактериальное действие уксуса против пищевых патогенных бактерий, включая Escherichia coli O157: H7. J Food Prot. 1998. 61 (8): 953–9. CAS Google ученый Рамезанализаде Ф., Раббани М., Хороуши М., Алиасгари А. Оценка in vitro антибактериальной активности гранатового уксуса и розовой воды по сравнению с полосканием для рта Persica против оральных бактерий.J Islam Dent Assoc Иран. 2015; 27 (3): 150–7. Google ученый Ayhan B, Bilici S. Toplu beslenme sistemlerinde kullanılan gıda dezenfektanları пищевые дезинфицирующие средства, которые используются в системах общественного питания. Турок Хидж Ден Бийол Дерг. 2015; 72 (4): 323–36 Доступно по ссылке: https://www.journalagent.com/turkhijyen/pdfs/THDBD_72_4_323_336.pdf. Google ученый Чен Х, Чен Т., Джудичи П., Чен Ф. Функции уксуса на здоровье: составляющие, источники и механизмы формирования. Compr Rev Food Sci Food Saf. 2016; 15 (6): 1124–38. CAS Google ученый Nastou A, Rhoades J, Smirniotis P, Makri I., Kontominas M, Likotrafiti E. Эффективность бытовых моющих средств для борьбы с Listeria monocytogenes на овощных салатах. Int J Food Microbiol. 2012. 159 (3): 247–53. CAS Google ученый Park SY, Kang S, Ha SD. Противомикробные эффекты уксуса против норовируса и Escherichia coli в традиционном корейском салате с зеленой умывальником ( Enteromorpha Кишечник ) при хранении в холодильнике. Int J Food Microbiol. 2016; 238: 208–14. CAS Google ученый Ryssel H, Kloeters O, Germann G, Schäfer T, Wiedemann G, Oehlbauer M. Антимикробный эффект уксусной кислоты — альтернатива обычным местным антисептикам? Бернс.2009. 35 (5): 695–700. CAS Google ученый Джудичи П., Гулло М., Сольери Л., Фальконе П.М. Технологические и микробиологические аспекты традиционного бальзамического уксуса и их влияние на качество и сенсорные свойства. В: «Достижения в исследованиях пищевых продуктов и питания», т. 58. 1-е изд. Кембридж: Elsevier Academic Press; 2009. с. 137–82. Лю Цюй, Тан Г.Й., Чжао ЦН, Гань Р.Й., Ли Х. Бин.Антиоксидантная активность, фенольные профили и содержание органических кислот во фруктовых уксусах. Антиоксиданты. 2019; 8 (4): 1–12. Google ученый Варга Дж., Кочубе С., Тот Б., Фрисвад Дж. К., Перроне Дж., Суска А. и др. Aspergillus brasiliensis sp. nov., двурядный черный вид Aspergillus, распространенный по всему миру. Int J Syst Evol Microbiol. 2007. 57 (8): 1925–32. CAS Google ученый Rabenau HF, Cinatl J, Morgenstern B, Bauer G, Preiser W, Doerr HW. Стабильность и инактивация коронавируса SARS. Med Microbiol Immunol. 2005. 194 (1–2): 1–6. CAS Google ученый Greatorex JS, Page RF, Curran MD, Digard P, Enstone JE, Wreghitt T. и др. Эффективность обычных бытовых чистящих средств в снижении жизнеспособности человеческого гриппа A / h2N1. PLoS One. 2010; 5 (2). Хайнцель М., Кьяс А., Вайде М., Бревес Р., Бокмюль Д. Оценка вирулицидного действия процедур домашней стирки. Int J Hyg Environ Health 2010; 213 (5): 334–337. Доступно по ссылке: http://dx.doi.org/https://doi.org/10.1016/j.ijheh.2010.06.003. RB Hygiene Home Deutschland GmbH. Sagrotan Desinfektion Hygienespüler. 2020. Лимонный сок или уксус: что более кислое?
Рикотта — это незрелый сыр, получаемый путем нагревания молока и отделения сухих веществ молока от сыворотки посредством процесса, называемого коагуляцией. Коагуляция происходит, когда белки, в данном случае твердые вещества молока, подвергаются повышенному нагреванию и в них вводится кислота.Когда в молоке происходит коагуляция, твердые частицы сжимаются и становятся более твердыми, образуя белые частицы, которые отделяются от желтоватой мутной жидкости — сыворотки.
The Chatelaine Kitchen несколько раз протестировала наш рецепт кремовой рикотты и выяснила, что все кислоты не взаимозаменяемы. Количество и тип используемой кислоты имеют решающее значение для кремовой, гладкой и вкусной рикотты. При приготовлении рикотты можно использовать разные кислоты, для некоторых методов требуется уксус (его тоже может быть широкий диапазон), а для других — лимонный сок.Мы протестировали с белым уксусом и лимонным соком и обнаружили, что лимонный сок делает рикотту более кремообразной, гладкой и вкусной. Наши испытания показали, что уксус дает более плотный и немного более жесткий продукт. Общее правило замены лимонного сока — использовать половину количества уксуса. Хотя, когда мы тестировали рецепт с половиной количества уксуса, результаты все равно бледнеют по сравнению с результатами с лимонным соком. Chatelaine Kitchen — это отчасти лаборатория, отчасти кухня, поэтому нам пришлось выяснить, почему две похожие кислоты реагируют так по-разному.
Наиболее существенное различие между лимонным соком и уксусом — это тип кислоты. Лимонный сок в среднем состоит из пяти-шести процентов лимонной кислоты. С другой стороны, уксус состоит из уксусной кислоты. В процентном отношении это зависит от уксуса. Белый уксус, как правило, содержит семь процентов уксусной кислоты, что выше, чем в других уксусах. Немного более мягкие уксусы, такие как бальзамический и красный винный уксус, содержат около шести процентов, а относительно мягкий рисовый винный уксус — около четырех с половиной процентов (ни один из которых вы бы не использовали для рикотты).Что касается pH, уксус немного более кислый, чем лимонный сок.
Как я уже упоминал, после того, как вы попробуете нашу домашнюю рикотту, вы не захотите возвращаться к упакованной разновидности.Домашняя рикотта хранится в холодильнике в течение недели, поэтому используйте ее по максимуму и попробуйте некоторые из этих рецептов: жареные помидоры кростини, пицца с курицей и рикоттой, рикотта и лимонные баклажаны, оладьи из овсяных отрубей рикотта с кленово-малиновым соусом Количественная оценка лимонной кислоты в лимонном соке, соке лайма и имеющихся в продаже фруктовых соках
KRISTINA L. PENNISTON
STEPHEN Y. NAKADA
РОСС П.HOLMES
DEAN G. ASSIMOS
Abstract
Предпосылки и цель
Материалы и методы
Результаты
Выводы
ВВЕДЕНИЕ
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Таблица 1
Всего лимонной кислоты Продукт Тип продукта n Среднее SD Лимонный сок свежий, из фруктов 2 48.0 3,82 Сок лайма свежий, из фруктов 2 45,8 6,86 Лимонный сок, Concord Foods концентрат сока концентрат сока 1 35,4 Лимонный сок, ReaLemon 100% концентрат сока 1 34.1 Грейпфрутовый сок, Florida’s Ruby Red готов к употреблению 1 25.0 Апельсиновый сок Tropicana Pure Premium готов к употреблению готов к употреблению 16,9 Апельсиновый сок, Tropicana Light ‘n Healthy готовый к употреблению 1 16,7 Апельсиновый сок свежий, из фруктов 2 1,98 Limeade / limonada, Minute Maid готовый к употреблению 1 7,30 Лимонад, Newman’s Own 735 готовый к употреблению Лимонад, Florida’s Natural готовый к употреблению 1 6.20 Лимонад, Minute Maid Light готовый к употреблению 1 20 Малиновый лимонад, Minute Maid , готовый к употреблению 1 5,00 Лимонад, Tropicana 0,6 Розовый лимонад Minute Maid готовый к употреблению 1 4,80 Лимонад Tropicana без сахара готовый к употреблению 3 0,44 Лимонад, Minute Maid готовый к употреблению 1 4,40 Лимонадный микс, Crystal Light напиток микс Смесь розового лимонада, Crystal Light смесь напитков 2 3,40 Смесь малинового лимонада, Crystal Light смесь напитков 1 3.10 Смесь лимонада, Kool-Aid Sugarfree смесь напитков 1 2,10 Лимонадная смесь, Country Time смесь напитков Кристаллизованный лимон, True Lemon сухая смесь 1 0,92 Пробоподготовка
Оборудование
Хроматографические условия
Статистические методы
РЕЗУЛЬТАТЫ
ОБСУЖДЕНИЕ
Ссылки
Сравнение действия угольной кислоты и других кислот на живую клетку
Бабушка знала лучше? Оценка антибактериальной, противогрибковой и противовирусной эффективности уксусной кислоты при процедурах домашнего ухода | BMC Microbiology
PubMed
PubMed
PubMed
PubMed
PubMed
PubMed Central
PubMed Central
PubMed
PubMed Central
PubMed
PubMed
PubMed
PubMed Central
PubMed
PubMed
PubMed
PubMed
PubMed
PubMed
PubMed
PubMed
PubMed Central
 вес(1)
вес(1) 0
0