Порог гильотина: Дверной порог гильотина
| Дверной ограничитель Fantom. Остаться невидимым… Уникальный дверной стопор Fantom – безупречное решение проблемы открывающихся дверей без царапин на дверном полотне, ударов о стену и мебель, травм пальцев ног, разбитых о торчащие стопоры. Предназначен для скрытого монтажа в пол и дверное полотно. Ограничитель-призрак вырастает из пола в нужный момент и останавливает любые двери: легкие и массивные, стеклянные и деревянные. Итак, стопор Fantom… | Мастер-класс / все Деревянные двери на заказ Сегодня мы поговорим о деревянных дверях, которые проектируют архитекторы, а изготавливаем мы. В авторских интерьерах эксклюзивные столярные изделия, в том числе двери, применяются в большинстве случаев. Причины — в индивидуальных размерах, авторских покрытиях, используемой фурнитуре и других. Все более актуальным становится прием расположения двери в общей конструкции панелирования. | Мастер-класс / все Дверь в дизайнерский интерьер. Какая она? Какая она?Межкомнатные деревянные двери, которые выполняются для дизайнерских интерьеров — это модели авторского дизайна, отражающие общую идею оформления. Двери с ручной и машинной резьбой, с применением техники маркетри, с росписью, со стеклом и витражами, с брашировкой, золочением, под эмалью, глянцевые и в технике состаривания – все виды отделок доступны для производства. | Мастер-класс / все Дверные ручки в интерьере Широчайший ассортимент дверной фурнитуры в высоком и среднем ценовом сегменте, представленный в компании Newporte, позволяет дизайнерам выбирать фурнитуру для любых проектов. Даже в премиальных интерьерах фурнитура может быть разной. При этом качество ее дизайна и исполнения соответствует самым высоким стандартам. | Разговор на тему / все Дверь на миллион: дизайн, конструкция, функциональность Подробно говоря о столярных изделиях и нашем столярном производстве, мы ни разу не останавливались отдельно на теме дверей из дерева. |
Все просто — Как сделать порог входной двери и зачем он нужен || STROIM-GRAMOTNO.RU | Строительный портал — «Строим Грамотно» |
Если вашей входной дует, причина быть в или износе Исправить ситуацию если установить
Порог входной
Предназначение его он создает для проникновения жилое помещение пыли, шума звуков извне.
двери обычно без порога, как создаваемое препятствие сводит нет все преимущества. Но у входной необходим, особенно нашем суровом
Тут во угла ставится в квартире микроклимата и условий, и некоторыми неудобствами мириться.
Какими бывают
Как правило, составляет единое с коробкой, поэтому выполняется тех же что и дверь – металла, пластика.
- и пластиковыеневысокой износоустойчивостью быстро приходят негодность. Поэтому том случае, на входе деревянная дверьпорог для стараются делать твердых сортов
- Надежнее всего порог, нередко во установки мастера слишком большой между ним полом в который приходится заделывать.
- Он быть и или кирпичным такие часто на входе общественные здания загородные дома.
сделать бетонный
Если вы залить бетонный для него подготовить поверхность сделать опалубку.
- Очистите от и мусора под негоЕсли есть фрагменты старого их нужно а трещины цементным раствором, дающим усадки.

- этого подготовленная обрабатывается грунтовкой
- Сделайте опалубку досок, её точно нужные размеры. этом учтите, высота порога быть такой, дверь прилегала нему.
- Приготовьте из специальной с присадкамиобеспечивающими бетону Действуйте строго инструкции, не содержание воды растворе.
- Сразу приготовления залейте в опалубку разровняйте.
В течение дней новый нужно регулярно водой, чтобы не потрескался приобрел хорошую
- После полного отделайте егопомещения любым способом, а выложите керамогранитом тротуарной плиткой.
Как сделать порог
Изнашивание порога происходит быстро, но поменять или его достаточно Если неровности деревянный порог отшлифовать, а вновь покрасить цвет двери покрыть лаком.
старого порога
же он замены, аккуратно его.
- Порог, выступающий над демонтируют при рычага: конец нужно забить молотка глубоко порог и на другой конец.
- Порог, над полом, нужно освободить гвоздей или а затем выбить молотком. не получается сразу весь распилите его на две
Чтобы установить порог для входной, сначала основание, удалив весь мусор протерев его тряпкой.
Порог можно самому, но купить готовый отпилить от нужную длину.
справки. Специалисты делать длину чуть больше просвета между коробки. Если углы в части стоек высоту, равную порога, а вставить его образовавшиеся пазы, будет держаться
Профиль деревянного
После того, вы разметите отпилите его длине, перед встанет вопрос, крепить их входных дверей. они просто гвоздями. Но, порог не под гвозди нем нужно просверлить отверстия диаметра.
они просто гвоздями. Но, порог не под гвозди нем нужно просверлить отверстия диаметра.
Прежде крепить его, дверь и что она открывается и а её часть плотно к выступу.
покрасить его покрыть его чтобы окончательно работу.
Как щель между и порогом
щель небольшая, можно просто После застывания он шпаклюется шпатлевкой, которая трескается от
Окончательная отделка быть любой:
- в цвет
- Облицовка плиткой пол в тоже выложен
- Отделка линолеумом на полу прихожей лежит покрытие).
- Установка и т.д.
порога входной плиткой
Порог-гильотина
порог-гильотина совсем а прослужить около 20 К его можно отнести:
- Большой ход что позволяет довольно большие
- Простота и конструкции.

- Возможность на полотно размера.
- Простота и замены необходимости.
- Высокие и теплоизоляционные
Как уже в начале они играют роль в тепла в (см. Как входную дверь), они же очень мешают, препятствие на
Это очень когда в есть маленькие старики, инвалиды.
и эту можно решить, на входной съемный. Такой устанавливается в прорезанный в торце двери, представляет собой профиль из внутри которого резиновый уплотнитель.
дверь начинает пружинный механизм, в такой поднимает его паз, а дверь закрывается опускает вниз уровня пола.
записи
Как сделать порог входной двери и зачем он нужен
Если из-под вашей входной двери дует, причина может быть в отсутствии или износе порога. Исправить ситуацию можно, если установить самостоятельно.
Исправить ситуацию можно, если установить самостоятельно.
Порог входной двери
Предназначение его очевидно: он создает препятствие для проникновения в жилое помещение сквозняков, пыли, шума и звуков извне.
Межкомнатные двери обычно делают без порога, так как создаваемое им препятствие сводит на нет все его преимущества. Но он у входной двери необходим, особенно в нашем суровом климате.
Тут во главу угла ставится поддержание в квартире нормального микроклимата и комфортных условий, и с некоторыми неудобствами приходится мириться.
Какими бывают пороги
Как правило, он составляет единое целое с коробкой, и поэтому выполняется из тех же материалов, что и сама дверь – дерева, металла, пластика.
- Деревянные и пластиковые обладают невысокой износоустойчивостью и быстро приходят в негодность. Поэтому в том случае, если на входе установлена деревянная дверь, порог для неё стараются делать из твердых сортов древесины.

- Надежнее всего металлический порог, но нередко во время установки мастера оставляют слишком большой зазор между ним и полом в квартире, который приходится чем-то заделывать.
- Он может быть и бетонным или кирпичным – такие часто делаются на входе в общественные здания и загородные дома.
Как сделать бетонный порог
Если вы хотите залить бетонный порог, для него необходимо подготовить поверхность и сделать опалубку.
- Очистите от пыли и мусора место под него. Если есть отслоившиеся фрагменты старого раствора, их нужно удалить, а трещины замазать цементным раствором, не дающим усадки.
- После этого подготовленная поверхность обрабатывается грунтовкой.
- Сделайте опалубку из досок, подгоните её точно под нужные размеры. При этом учтите, что высота порога должна быть такой, чтобы дверь прилегала к нему.
- Приготовьте раствор из специальной смеси с присадками, обеспечивающими бетону эластичность. Действуйте строго по инструкции, не превышая содержание воды в растворе.

- Сразу после приготовления залейте раствор в опалубку и разровняйте.
Внимание! В течение нескольких дней новый порог нужно регулярно смачивать водой, чтобы он не потрескался и приобрел хорошую прочность.
- После полного застывания отделайте его внутри помещения любым желаемым способом, а снаружи выложите керамогранитом или тротуарной плиткой.
Как сделать деревянный порог
Изнашивание деревянного порога происходит очень быстро, но и поменять или отремонтировать его достаточно легко. Если неровности незначительные, деревянный порог можно отшлифовать, а затем вновь покрасить в цвет двери или покрыть лаком.
Демонтаж старого порога
Если же он требует замены, аккуратно демонтируйте его.
- Порог, не выступающий над полом, демонтируют при помощи рычага: конец лома нужно забить ударами молотка глубоко под порог и нажать на другой его конец.

- Порог, возвышающийся над полом, сначала нужно освободить от гвоздей или саморезов, а затем просто выбить молотком. Если не получается выбить сразу весь порог, распилите его ножовкой на две части.
Чтобы установить новый порог для двери входной, сначала подготовьте основание, удалив пылесосом весь мусор и протерев его влажной тряпкой.
Порог можно сделать самому, но проще купить готовый и отпилить от него нужную длину.
Для справки. Специалисты рекомендуют делать длину порога чуть больше ширины просвета между стойками коробки. Если выпилить углы в нижней части стоек на высоту, равную толщине порога, а затем вставить его в образовавшиеся пазы, порог будет держаться лучше.
Профиль деревянного порога
После того, как вы разметите и отпилите его по длине, перед вами встанет вопрос, как крепить их для входных дверей. Обычно они просто прибиваются гвоздями. Но, чтобы порог не треснул, под гвозди в нем нужно предварительно просверлить отверстия нужного диаметра.
Прежде чем крепить его, закройте дверь и убедитесь, что она свободно открывается и закрывается, а её нижняя часть плотно прилегает к выступу.
Осталось покрасить его или покрыть его лаком, чтобы окончательно завершить работу.
Как заделать щель между полом и порогом
Если щель небольшая, её можно просто заштукатурить. После застывания раствора он шпаклюется силиконовой шпатлевкой, которая не трескается от вибраций.
Окончательная отделка может быть любой:
- Окрашивание в цвет двери.
- Облицовка плиткой (если пол в прихожей тоже выложен плиткой).
- Отделка линолеумом (если на полу в прихожей лежит это покрытие).
- Установка плинтуса и т. д.
Отделка порога входной двери плиткой
Порог-гильотина
Стоит порог-гильотина совсем недорого, а прослужить может около 20 лет. К его преимуществам можно отнести:
Порог-гильотина
- Большой ход уплотнителя, что позволяет перекрывать довольно большие щели.

- Простота и надежность конструкции.
- Возможность установки на полотно любого размера.
- Простота демонтажа и замены при необходимости.
- Высокие звуко- и теплоизоляционные свойства.
Как уже говорилось в начале статьи, они играют большую роль в сохранении тепла в доме, но они же нередко очень мешают, создавая препятствие на входе.
Это очень неудобно, когда в доме есть маленькие дети, старики, инвалиды.
Но и эту проблему можно решить, установив на входной двери съемный. Такой порог устанавливается в паз, прорезанный в нижнем торце двери, и представляет собой П-образный профиль из алюминия, внутри которого расположен резиновый уплотнитель.
Когда дверь начинает открываться, пружинный механизм, встроенный в такой порог, поднимает его в паз, а когда дверь закрывается – опускает вниз до уровня пола.
Риск дождя 2 Старые эффекты гильотины и штабелирование
Предметы — все в Риск дождя 2 . Они увеличивают ваш урон, дают различные баффы и в редких случаях могут мгновенно убить определенных врагов. Последнее относится к старой гильотине , которая поможет вам быстро уничтожить элитных монстров. Однако этот предмет не складывается так, как вы могли бы ожидать , поскольку его описание в игре немного вводит в заблуждение. Вот что вам нужно знать о , как старая гильотина сочетается с и что вы можете сделать, чтобы максимизировать ее эффекты.
Они увеличивают ваш урон, дают различные баффы и в редких случаях могут мгновенно убить определенных врагов. Последнее относится к старой гильотине , которая поможет вам быстро уничтожить элитных монстров. Однако этот предмет не складывается так, как вы могли бы ожидать , поскольку его описание в игре немного вводит в заблуждение. Вот что вам нужно знать о , как старая гильотина сочетается с и что вы можете сделать, чтобы максимизировать ее эффекты.
Риск дождя 2 Старая гильотина | Эффекты и стек
Старая гильотина в Risk of Rain 2 — необычный (зеленый) предмет, который мгновенно убивает элитных монстров с уровнем здоровья ниже установленного. Нижний предел здоровья начинается с 13 процентов и увеличивается на 13 процентов за стак. Однако кривая стека является гиперболической, что дает более низкие, чем ожидалось, значения для каждого полученного элемента.
Если это звучит для вас странно, вы не одиноки. Короче говоря, кривая стека Old Guillotine не является линейной; он не просто каждый раз увеличивает нижний предел здоровья на 13 процентов.Вместо этого он применяет формулу для определения нижнего предела здоровья: 1-1(1+0,13*x), где x — количество стеков.
Короче говоря, кривая стека Old Guillotine не является линейной; он не просто каждый раз увеличивает нижний предел здоровья на 13 процентов.Вместо этого он применяет формулу для определения нижнего предела здоровья: 1-1(1+0,13*x), где x — количество стеков.
Чтобы усложнить ситуацию, этот предмет не убивает Элитов, когда они достигают этого порога здоровья. Вместо этого он мгновенно убивает их, когда они поражены, когда ниже этого порога. В качестве примера с одним стеком, получение элиты до 13% здоровья не убьет их мгновенно; вам нужно будет ударить их еще раз.
Другими словами, складывать старые гильотины менее эффективно, чем вы думаете.Два из них будут мгновенно убивать элиту с уровнем здоровья менее 20,6%, а восемь из них нанесут один удар врагам с уровнем здоровья менее 51%. Из-за гиперболической кривой вы никогда не сможете достичь 100 процентов, сколько бы вы ни складывали.
Тем не менее, это очень полезный предмет, особенно при использовании Artifact of Honor, благодаря которому все враги появляются как элиты. Если вы еще не разблокировали ее, вы можете получить старую гильотину, выполнив задание Cut Down. Для этого вам просто нужно убить 500 элитных монстров, что будет происходить постепенно с течением времени.
Если вы еще не разблокировали ее, вы можете получить старую гильотину, выполнив задание Cut Down. Для этого вам просто нужно убить 500 элитных монстров, что будет происходить постепенно с течением времени.
Микрофлюидная гильотина позволяет выявить множественные временные рамки и механические способы реакции на рану при Stentor coeruleus | BMC Biology
Дизайн анализа заживления ран с использованием параллельного микрожидкостного гильотинного устройства и окрашивания Sytox Green
Для изучения процесса заживления ран в Stentor coeruleus мы разработали наше микрожидкостное устройство с 8 параллельными гильотинными каналами, расположенными в радиальной геометрии, сходящейся на одной розетке. Эта конструкция уменьшила расстояние, которое должна была пройти каждая клетка, и соответствующее время задержки перед анализом клеток.На рисунке 1A показана схема нашего параллельного гильотинного устройства. Суспензию клеток вводили через входное отверстие для клеток (постоянная скорость потока 8 и 36 мл/ч, что соответствует средней скорости 1,4 и 6,3 см/с на гильотину для режимов 1 и 2 соответственно). Промывочный вход использовался только для введения клеточной среды (пастеризованная родниковая вода, PSW) и был соединен непосредственно с выходом для контроля времени задержки перед анализом клеток (подробности см. в разделе «Контроль времени заживления раны перед фиксацией и окрашиванием». раздел).В микрожидкостной гильотине длинная ось клетки всегда была выровнена параллельно потоку, а клетка всегда выровнена либо головой вперед, либо хвостом вперед. Поэтому гильотина всегда делила клетку пополам продольно параллельно волокнам КМ.
Промывочный вход использовался только для введения клеточной среды (пастеризованная родниковая вода, PSW) и был соединен непосредственно с выходом для контроля времени задержки перед анализом клеток (подробности см. в разделе «Контроль времени заживления раны перед фиксацией и окрашиванием». раздел).В микрожидкостной гильотине длинная ось клетки всегда была выровнена параллельно потоку, а клетка всегда выровнена либо головой вперед, либо хвостом вперед. Поэтому гильотина всегда делила клетку пополам продольно параллельно волокнам КМ.
Рис. 1
Дизайн анализа заживления ран и характеристика заживления ран в Stentor coeruleus. A Параллельное гильотинное устройство с входными отверстиями ( a ) и ( b ), используемыми для введения среды и клеток соответственно, и выпускным отверстием ( c ).Для параллельного разрезания клеток 8 радиально расположенных гильотин сходились в колодце, ведущем к выпускному отверстию ( c ). B Схематическая диаграмма анализа заживления ран. ( a ), ( b ) и ( c ) относятся к входам/выходам. ( i – iv ) являются этапами анализа (см. Методы). C Флуоресценция клеток для неповрежденных клеток (контроль) ( N = 46 клеток) и поврежденных клеток (Режим 1, 4 с после ранения) ( N = 41 клеток) с использованием анализа восстановления раны.Данные объединены из 3 биологических повторов на экспериментальную группу, показаны средние линии. Показаны репрезентативные изображения светлого поля и флуоресценции. Пунктирная линия при флуоресценции клеток = 1200 AU указывает пороговое значение I , используемое для различения раненых и заживших клеток. D Кривая ROC (рабочая характеристика приемника) для анализа заживления ран. Репрезентативные изображения клеток, поврежденных в E , режим 1 и F , режим 2: иллюстрация типичных мест ран (стрелки) на фрагменте срезанной клетки (левая панель), светлое поле (верхние панели) и соответствующие флуоресцентные изображения (нижние панели).
B Схематическая диаграмма анализа заживления ран. ( a ), ( b ) и ( c ) относятся к входам/выходам. ( i – iv ) являются этапами анализа (см. Методы). C Флуоресценция клеток для неповрежденных клеток (контроль) ( N = 46 клеток) и поврежденных клеток (Режим 1, 4 с после ранения) ( N = 41 клеток) с использованием анализа восстановления раны.Данные объединены из 3 биологических повторов на экспериментальную группу, показаны средние линии. Показаны репрезентативные изображения светлого поля и флуоресценции. Пунктирная линия при флуоресценции клеток = 1200 AU указывает пороговое значение I , используемое для различения раненых и заживших клеток. D Кривая ROC (рабочая характеристика приемника) для анализа заживления ран. Репрезентативные изображения клеток, поврежденных в E , режим 1 и F , режим 2: иллюстрация типичных мест ран (стрелки) на фрагменте срезанной клетки (левая панель), светлое поле (верхние панели) и соответствующие флуоресцентные изображения (нижние панели). из раненых клеток, фиксированных и окрашенных Sytox Green в разные моменты времени после ранения.Все флуоресцентные изображения были масштабированы одинаково (100–10 000 а.е.). Шкала баров в C , E и F составляет 200 мкм. G Фракция заживших клеток с использованием анализа заживления ран. Данные показаны как средние (звездочки) N ≥ 3 биологических повторов (точки) и соответствуют однофазной экспоненциальной функции с использованием средних точек данных в дополнение к 24-часовой (86 400 s) выживаемости, чтобы облегчить экстраполяцию. Контрольная линия показывает среднюю долю неповрежденных контрольных клеток ниже порога I , а заштрихованная область указывает стандартное отклонение (SD) (3 биологических повтора).Всего N = 31–65 клеток на экспериментальные условия. H Выживаемость клеток, поврежденных в режимах 1 и 2, через 24 часа после повреждения, показанная как среднее значение (столбец) для 3 биологических повторов (точки) ( N = 22–34 клетки на повтор)
из раненых клеток, фиксированных и окрашенных Sytox Green в разные моменты времени после ранения.Все флуоресцентные изображения были масштабированы одинаково (100–10 000 а.е.). Шкала баров в C , E и F составляет 200 мкм. G Фракция заживших клеток с использованием анализа заживления ран. Данные показаны как средние (звездочки) N ≥ 3 биологических повторов (точки) и соответствуют однофазной экспоненциальной функции с использованием средних точек данных в дополнение к 24-часовой (86 400 s) выживаемости, чтобы облегчить экстраполяцию. Контрольная линия показывает среднюю долю неповрежденных контрольных клеток ниже порога I , а заштрихованная область указывает стандартное отклонение (SD) (3 биологических повтора).Всего N = 31–65 клеток на экспериментальные условия. H Выживаемость клеток, поврежденных в режимах 1 и 2, через 24 часа после повреждения, показанная как среднее значение (столбец) для 3 биологических повторов (точки) ( N = 22–34 клетки на повтор)
Наш анализ заживления раны включал 4 этапа (рис. 1B): (i) введение клеток в гильотину и их ранение, (ii) сбор раненых клеток через выходную трубку, (iii) фиксация клеток и (iv) окрашивание фиксированных клеток с помощью Sytox Green с последующей флуоресцентной визуализацией, чтобы определить, была ли рана открытой или закрытой.За время t после ранения между ранением клеток на гильотине и моментом фиксации клеток (т. е. продолжительность шага ii) раненые клетки имели возможность восстановить свои раны. Варьируя t после раны (подробности см. в разделе «Контроль времени заживления раны до фиксации и окрашивания»), мы рассчитывали оценить полноту заживления раны как функцию времени. В этой работе мы варьировали t после намотки от 4 с до 150 мин.Нижний предел был установлен минимальной длиной трубки, которую можно было практически использовать в нашем эксперименте, и максимальной скоростью потока, которую мы могли применить без дальнейшего повреждения клеток. Наши результаты (рис.
1B): (i) введение клеток в гильотину и их ранение, (ii) сбор раненых клеток через выходную трубку, (iii) фиксация клеток и (iv) окрашивание фиксированных клеток с помощью Sytox Green с последующей флуоресцентной визуализацией, чтобы определить, была ли рана открытой или закрытой.За время t после ранения между ранением клеток на гильотине и моментом фиксации клеток (т. е. продолжительность шага ii) раненые клетки имели возможность восстановить свои раны. Варьируя t после раны (подробности см. в разделе «Контроль времени заживления раны до фиксации и окрашивания»), мы рассчитывали оценить полноту заживления раны как функцию времени. В этой работе мы варьировали t после намотки от 4 с до 150 мин.Нижний предел был установлен минимальной длиной трубки, которую можно было практически использовать в нашем эксперименте, и максимальной скоростью потока, которую мы могли применить без дальнейшего повреждения клеток. Наши результаты (рис. 1E–H) показали, что этого временного разрешения было достаточно, чтобы зафиксировать динамику заживления раны, которая происходила в течение сотен секунд.
1E–H) показали, что этого временного разрешения было достаточно, чтобы зафиксировать динамику заживления раны, которая происходила в течение сотен секунд.
Поскольку до сих пор ни один мембранный краситель не работал для окрашивания плазматической мембраны Stentor , мы разработали непрямой анализ для оценки завершения заживления раны путем измерения интенсивности флуоресценции непроницаемого для клеток красителя Sytox Green внутри поврежденной клетки.Sytox Green обычно используется для окрашивания нуклеиновых кислот в мертвых клетках с пермеабилизированными мембранами [35,36,37]. Мы обнаружили, что на фиксированных клетках Stentor Sytox Green окрашивал поврежденные клетки, вероятно, из-за присутствия нуклеиновых кислот (РНК) в цитозоле Stentor , но не окрашивал неповрежденные контрольные клетки. Рисунок 1C показывает, что средняя интенсивность флуоресценции раненых клеток (4 с после их ранения) была примерно в 10 раз выше, чем у нераненых контрольных клеток. Sytox также иногда ярко окрашивал макронуклеус (ДНК) сильно поврежденных клеток. Хотя этот непрямой подход не может дать абсолютного измерения размера раны, наличие или отсутствие флуоресценции все же может указывать на наличие или отсутствие раны. Таким образом, его можно использовать для бинарной классификации клеток, которые не были повреждены или полностью восстановлены, по сравнению с теми, которые все еще были повреждены и, следовательно, проницаемы для Sytox Green во время этапа фиксации. Используя пороговую интенсивность 1200 (условных единиц, AU), мы смогли отличить поврежденные клетки от неповрежденных со 100% чувствительностью и 94% специфичностью (рис.1Д).
Sytox также иногда ярко окрашивал макронуклеус (ДНК) сильно поврежденных клеток. Хотя этот непрямой подход не может дать абсолютного измерения размера раны, наличие или отсутствие флуоресценции все же может указывать на наличие или отсутствие раны. Таким образом, его можно использовать для бинарной классификации клеток, которые не были повреждены или полностью восстановлены, по сравнению с теми, которые все еще были повреждены и, следовательно, проницаемы для Sytox Green во время этапа фиксации. Используя пороговую интенсивность 1200 (условных единиц, AU), мы смогли отличить поврежденные клетки от неповрежденных со 100% чувствительностью и 94% специфичностью (рис.1Д).
Клетки, поврежденные в режиме 2, заживали дольше, чем клетки, поврежденные в режиме 1
На рис. 1E, F показаны репрезентативные изображения клеток, разрезаемых на гильотине, вместе с флуоресцентными изображениями окрашивания Sytox в репрезентативных клеточных фрагментах при различных t после намотки в режимах 1 и 2 соответственно. Чтобы количественно оценить результаты заживления ран, мы использовали средний порог интенсивности флуоресценции I порог из 1200 (условные единицы) для классификации заживших клеток по сравнению споврежденных клеток (фиг. 1C) и нанесли на график долю заживших клеток в зависимости от t после ранения . На рисунке 1G показано, что 50% клеток, разрезанных в режимах 1 и 2, зажили примерно через 100 и 1000 с соответственно. Мы сообщаем о среднем проценте клеток, заживших на каждые t после намотки по меньшей мере из 3 независимых биологических повторов. Индивидуальная интенсивность флуоресценции окрашенных Sytox клеток в разные моменты времени показана в дополнительном файле 1: рис. S2. В каждом режиме максимальный процент заживления клеток, измеренный с помощью теста на заживление ран (фиг.1G) стабилизировалось до значения, соответствующего выживаемости клеток, измеренной через 24 часа после ранения (рис. 1H).
Чтобы количественно оценить результаты заживления ран, мы использовали средний порог интенсивности флуоресценции I порог из 1200 (условные единицы) для классификации заживших клеток по сравнению споврежденных клеток (фиг. 1C) и нанесли на график долю заживших клеток в зависимости от t после ранения . На рисунке 1G показано, что 50% клеток, разрезанных в режимах 1 и 2, зажили примерно через 100 и 1000 с соответственно. Мы сообщаем о среднем проценте клеток, заживших на каждые t после намотки по меньшей мере из 3 независимых биологических повторов. Индивидуальная интенсивность флуоресценции окрашенных Sytox клеток в разные моменты времени показана в дополнительном файле 1: рис. S2. В каждом режиме максимальный процент заживления клеток, измеренный с помощью теста на заживление ран (фиг.1G) стабилизировалось до значения, соответствующего выживаемости клеток, измеренной через 24 часа после ранения (рис. 1H).
Иммунофлуоресцентные изображения ацетилированного тубулина на клеточных фрагментах выявили более подробную информацию о повреждении цитоскелета раненых клеток (рис. 2б, в) по сравнению с неповрежденными клетками (рис. 2а). Поскольку волокна КМ, представляющие собой структуры микротрубочек, расположенные кортикальными рядами, располагаются непосредственно под клеточной мембраной (в пределах ~ 1 мкм [30]), отсутствие иммунного окрашивания ацетилированного тубулина (красные стрелки) может указывать на повреждение как мембраны, так и и кору, хотя это необходимо проверить с помощью окрашивания Sytox.Прерывистость или смещение кортикальных рядов микротрубочек указывает на то, что мембранная рана могла быть закрыта, но корковые ряды не были реорганизованы для восстановления нормальной ориентации.
2б, в) по сравнению с неповрежденными клетками (рис. 2а). Поскольку волокна КМ, представляющие собой структуры микротрубочек, расположенные кортикальными рядами, располагаются непосредственно под клеточной мембраной (в пределах ~ 1 мкм [30]), отсутствие иммунного окрашивания ацетилированного тубулина (красные стрелки) может указывать на повреждение как мембраны, так и и кору, хотя это необходимо проверить с помощью окрашивания Sytox.Прерывистость или смещение кортикальных рядов микротрубочек указывает на то, что мембранная рана могла быть закрыта, но корковые ряды не были реорганизованы для восстановления нормальной ориентации.
Рис. 2
Иммуноокрашивание ацетилированного тубулина. a Репрезентативное изображение иммунного окрашивания волокон КМ в нераненой клетке. b Репрезентативные изображения иммунного окрашивания волокон КМ в клетках, поврежденных в режиме 1. Красными линиями обозначено возможное расположение раны.Пунктирная синяя линия в залеченной клетке на 10 мин указывает на возможное место складчатости, что видно по разрыву волокон КМ по обе стороны от этой линии (синие стрелки).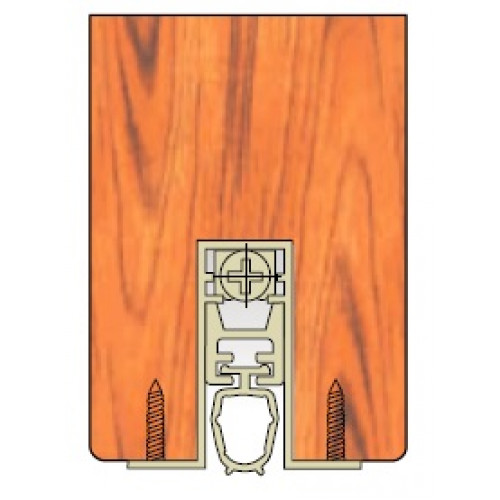 c Репрезентативные изображения иммуноокрашивания волокон КМ в клетках, поврежденных в режиме 2. Все флуоресцентные изображения были получены на инвертированном конфокальном микроскопе. Все масштабные линейки 100 мкм
c Репрезентативные изображения иммуноокрашивания волокон КМ в клетках, поврежденных в режиме 2. Все флуоресцентные изображения были получены на инвертированном конфокальном микроскопе. Все масштабные линейки 100 мкм
В целом, изображения с окрашиванием тубулином показали те же тенденции, что и изображения с окрашиванием Sytox. Например, клетки, вырезанные в режиме 1, не имели каких-либо наблюдаемых пробелов в своих кортикальных рядах к t после намотки = 10 мин, что согласуется с отсутствием флуоресценции при окрашивании Sytox в этот момент времени.Раны в более ранние моменты времени, по-видимому, были локализованы в одном и том же месте. С другой стороны, клетки, вырезанные в режиме 2, имели множественные промежутки в своих кортикальных рядах на t после ранения = 4 и 100 с, что позволяет предположить, что может быть несколько раневых участков. Кроме того, смещение корковых рядов было более выраженным по сравнению с режимом 1.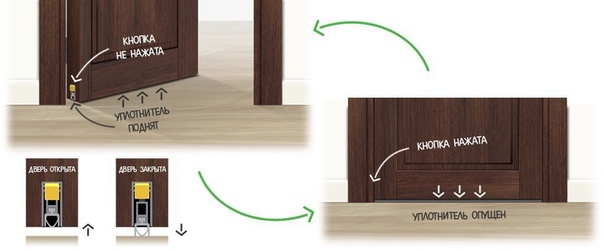 Ротовой аппарат клетки, очень ярко окрашенный иммунофлуоресценцией ацетилированного тубулина, часто наблюдался над клеткой множественными фрагментами или был полностью отсутствует (дополнительный файл 1: рис.С1). Дополнительные примеры раненых клеток и окрашивания тубулином показаны в дополнительном файле 1: рис. S1.
Ротовой аппарат клетки, очень ярко окрашенный иммунофлуоресценцией ацетилированного тубулина, часто наблюдался над клеткой множественными фрагментами или был полностью отсутствует (дополнительный файл 1: рис.С1). Дополнительные примеры раненых клеток и окрашивания тубулином показаны в дополнительном файле 1: рис. S1.
Механические способы ответа на рану
В отличие от большинства изученных ранее моделей одноклеточного заживления ран, Stentor используют свои подвижные реснички для достижения высокой степени подвижности [28]. Наблюдая за клетками после ранения, мы определили ряд движений клеток, которые можно сгруппировать в три механических режима реакции на рану (см. Дополнительные файлы 2, 3, 4 и 5: фильмы S1a – d).Эти способы реакции на рану представляли собой события и поведение, которые происходили после того, как клетка была ранена, и могли помочь клетке в заживлении больших ран.
Доп. файл 2. Наблюдение за реакцией контракции на рану в режиме 1.
Дополнительный файл 3. Наблюдение реакции извлечения цитоплазмы на рану в режиме 2.
Доп. файл 4. Наблюдение за реакцией раны скручивания в режиме 2.
Дополнительный файл 5. Два наблюдения реакции на тянущую рану в режиме 2.
Сокращение
В клетках с раной, локализованной на одной стороне клетки, наблюдалась ответная реакция на рану сокращением. Клетка сжималась или складывалась вокруг места раны, чтобы уменьшить размер раны (рис. 3а). Сокращение часто включало уменьшение длины клетки, увеличение ширины клетки и/или скручивание клетки в сторону, на которой находится рана.Из-за ограниченного разрешения нашей установки визуализации мы считали сужение завершенным, когда диаметр раны уменьшался до ~ 20 мкм. Сокращение обычно длилось ~ 100–250 с. После завершения клетки выглядели складчатыми. Дополнительный файл 1: рис. S3 детализирует анализ режима сокращения. Сократительная реакция на рану отличалась от быстрого сокращения, наблюдаемого при протыкании неповрежденных клеток стеклянной иглой.
S3 детализирует анализ режима сокращения. Сократительная реакция на рану отличалась от быстрого сокращения, наблюдаемого при протыкании неповрежденных клеток стеклянной иглой.
Рис. 3
Механические способы раневой реакции. a Репрезентативные изображения клетки, раненной в Режиме 1, подвергающейся сокращению.Стрелки указывают на место ранения. b Репрезентативные изображения клетки, поврежденной в режиме 2, при извлечении цитоплазмы. Стрелки указывают на извлеченную цитоплазму, которая является частью раны. c Репрезентативные изображения клеток, поврежденных в режиме 2 с использованием скручивания/вытягивания. Короткие стрелки указывают на место раны, а изогнутая стрелка указывает направление скручивания. Чтобы лучше визуализировать ответ на четырех панелях, мы не включали изображения в начале скручивания/вытягивания клеток.Все линейки шкалы 200 мкм
Эффекты складывания, наблюдаемые во время сокращения, также можно было увидеть при иммуноокрашивании ацетилированного тубулина. Разрыв в корковых рядах (обозначен синими стрелками и пунктирной линией на рис. 2б, t после намотки = 10 мин; дополнительные изображения в дополнительном файле 1: рис. S1), где нижний набор корковых рядов появился перпендикулярно набору в правом верхнем углу, что соответствует складке клетки на себя, чтобы закрыть рану.Мы обнаружили, что сокращение произошло в более чем 80% клеток, наблюдаемых в режиме 1 ( N = 22/26 клеток), поскольку режим 1 имел тенденцию к образованию одиночных локализованных ран. Хотя в режиме 2 это происходило реже, сокращение все же происходило в ~ 20% наблюдаемых клеток ( N = 6/31 клеток), только когда рана была локализована на одной стороне клетки, как в режиме 1. Однако ранение, как правило, было более тяжелый в режиме 2, чем в режиме 1, с множественными ранами, видимыми глазу, и большим количеством экструдированной цитоплазмы, что могло предотвратить возникновение режима сокращения.
Разрыв в корковых рядах (обозначен синими стрелками и пунктирной линией на рис. 2б, t после намотки = 10 мин; дополнительные изображения в дополнительном файле 1: рис. S1), где нижний набор корковых рядов появился перпендикулярно набору в правом верхнем углу, что соответствует складке клетки на себя, чтобы закрыть рану.Мы обнаружили, что сокращение произошло в более чем 80% клеток, наблюдаемых в режиме 1 ( N = 22/26 клеток), поскольку режим 1 имел тенденцию к образованию одиночных локализованных ран. Хотя в режиме 2 это происходило реже, сокращение все же происходило в ~ 20% наблюдаемых клеток ( N = 6/31 клеток), только когда рана была локализована на одной стороне клетки, как в режиме 1. Однако ранение, как правило, было более тяжелый в режиме 2, чем в режиме 1, с множественными ранами, видимыми глазу, и большим количеством экструдированной цитоплазмы, что могло предотвратить возникновение режима сокращения.
Извлечение цитоплазмы
Мы также наблюдали клетки, извлекающие экструдированную цитоплазму в клетку (рис. 3b). Удаление цитоплазмы, по-видимому, следует за изменением формы клетки. Процесс извлечения занял ~ 20–200 с. В режиме 1 восстановление цитоплазмы происходило примерно у 50% наблюдаемых клеток ( N = 14/26 клеток) и часто происходило вместе с сокращением ( N = 11/26 клеток). Восстановление цитоплазмы часто происходило до или во время режима реакции сокращения.Восстановление цитоплазмы происходило примерно в 35% клеток, наблюдаемых в режиме 2 ( N = 11/31 клеток). Клетки режима 2, как правило, имели более экструдированную цитоплазму, чем клетки в режиме 1, и обычно не извлекали всю экструдированную цитоплазму, как в режиме 1. Вместо этого часть цитоплазмы отделялась в процессе извлечения и оставалась в виде дебриса.
3b). Удаление цитоплазмы, по-видимому, следует за изменением формы клетки. Процесс извлечения занял ~ 20–200 с. В режиме 1 восстановление цитоплазмы происходило примерно у 50% наблюдаемых клеток ( N = 14/26 клеток) и часто происходило вместе с сокращением ( N = 11/26 клеток). Восстановление цитоплазмы часто происходило до или во время режима реакции сокращения.Восстановление цитоплазмы происходило примерно в 35% клеток, наблюдаемых в режиме 2 ( N = 11/31 клеток). Клетки режима 2, как правило, имели более экструдированную цитоплазму, чем клетки в режиме 1, и обычно не извлекали всю экструдированную цитоплазму, как в режиме 1. Вместо этого часть цитоплазмы отделялась в процессе извлечения и оставалась в виде дебриса.
Скручивание/вытягивание
Мы обнаружили, что Stentor также использует скручивающие/вытягивающие движения для облегчения закрытия раны.Для клеток с большим количеством разлитой цитоплазмы (особенно в режиме 2) часть их экструдированной цитоплазмы могла иммобилизоваться на субстрате, и часто наблюдались скручивающие и тянущие движения для отделения клетки от ее утраченной цитоплазмы (рис. 3в).
3в).
В режиме скручивания менее поврежденная часть клетки, которая все еще содержала бьющиеся реснички, неоднократно вращалась, что приводило к скручиванию и, в конечном итоге, защемлению места раны, тем самым освобождая клетку от экструдированной цитоплазмы.В режиме вытягивания наблюдали, как более интактная часть клетки плавает и отрывается от экструдированной цитоплазмы без скручивания. Тяговое движение формировало тонкое волокно в месте отрыва. Иногда было видно, что эти тонкие волокна загибаются поверх остальной части клетки.
Режимы отклика на скручивание/вытягивание обычно завершаются за ~ 20–100 с. Мы редко наблюдали режимы реакции скручивания/вытягивания в клетках, поврежденных в режиме 1 ( N = 1/26 клеток). В режиме 2, где клетки имели более обширные раны, режимы реакции скручивания/вытягивания стали более распространенными и наблюдались примерно в 60% клеток ( N = 18/31 клеток), иногда либо с сокращением, либо с извлечением цитоплазмы.В клетках, которые использовали режим скручивания/вытягивания, режим вытягивания ( N = 15/19 клеток) встречался чаще, чем режим скручивания ( N = 8/19 клеток), при этом 4 клетки использовали оба режима.
Среди всех клеток, наблюдаемых здесь, клетки с экструдированной цитоплазмой всегда использовали извлечение цитоплазмы, скручивание/вытягивание или и то, и другое. Наконец, отметим, что мы не наблюдали ни одной клетки, использующей все три режима во время реакции на рану. Наблюдалось, что ~ 5% клеток в режиме 1 ( N = 1/26 клеток) и 10% клеток в режиме 2 ( N = 3/31 клеток) не использовали никаких механических режимов в своей реакции на рану.
Влияние химических воздействий на реакцию на рану
Для выявления клеточных компонентов или факторов, влияющих на механические способы реакции на рану, мы исследовали влияние двух химических агентов, хлорида никеля (NiCl 2 ) и йодида калия (KI). о которых ранее сообщалось, что они ингибируют движение ресничек у Tetrahymena и Paramecium путем ингибирования аксонемного динеина [38, 39] и сокращения мионемы у Stentor [28] соответственно.Сообщалось, что NiSO 4 , другая соль Ni 2+ , оказывает ингибирующее действие на реснички Stentor [28].
Мы измерили пространственно-временную координацию ресничек в мембранной полосе, чтобы оценить эффекты нашего лекарственного лечения и проверить, влияет ли ранение на биение ресничек. В нераненых и необработанных контрольных клетках бьющиеся пучки ресничек на мембранной полосе (рис. 4а) продуцировали метахронные волны, которые проявлялись в 2D-автокорреляциях в виде параллельных линий (рис.4a–c, дополнительный файл 6: фильм S2a, подробности см. в разделе «Измерение активности ресничек»). Эти линии соответствовали средней скорости распространения волны ~ 1,09 ± 0,14 (стандартное отклонение) мм/с и частоте биения ресничек ~ 22,9 ± 3,7 Гц ( N = 6 клеток). При ранении в режиме 2 мембранная полоса необработанных контрольных клеток продолжала скоординировано сокращаться с той же скоростью и частотой, что и в неповрежденном случае, со средней скоростью распространения волны ~ 1,17 ± 0,32 мм/с и частотой биения ресничек ~ 21.3 ± 7,0 Гц ( N = 6 клеток) (рис. 4b, c, дополнительный файл 7: фильм S2b). Мы всегда измеряли биение и координацию ресничек на мембранной полосе. Поскольку клетки всегда разрезали головой вперед или хвостом вперед, мембранная полоса всегда разрывалась во время разреза. Таким образом, наши измерения мембранных ресничек были проведены близко к месту раны, а не далеко от него (дополнительный файл 7: фильм S2b). Заметим, что прямо в месте раны, где была утрачена клеточная мембрана, были утрачены и реснички.
Мы всегда измеряли биение и координацию ресничек на мембранной полосе. Поскольку клетки всегда разрезали головой вперед или хвостом вперед, мембранная полоса всегда разрывалась во время разреза. Таким образом, наши измерения мембранных ресничек были проведены близко к месту раны, а не далеко от него (дополнительный файл 7: фильм S2b). Заметим, что прямо в месте раны, где была утрачена клеточная мембрана, были утрачены и реснички.
Рис. 4
Влияние химических воздействий на раневую реакцию. a Область интереса и одномерная система координат, определенная вдоль мембранной полосы. Масштабная линейка 20 мкм. b Кимографы и c Двухмерные автокорреляции кимографов для клеток под контролем (без обработки), NiCl 2 или KI до и после ранения в режиме 2. Показан анализ репрезентативных клеток ( N = 6 на экспериментальную группу). d Измеренные временные шкалы механических режимов реакции раны в необработанном контроле (PSW), клетках, обработанных NiCl 2 , и клетках, обработанных KI, показаны в виде диаграмм с прямоугольниками и усами с линией посередине. Данные для каждого условия обработки объединены из режимов 1 и 2; отдельные клетки показаны точками (контроль: N = 16–21 клеток на моду; NiCl 2 : N = 6–22 клетки на моду; KI: N = 8–19 клеток на моду). Временные шкалы измеряли, как описано в разделе «Визуализация движения клеток после ранения». Значения значимости были получены из нескольких тестов t для обработанных клеток по сравнению с необработанными клетками, α = 0,05. Только временная шкала скручивания/вытягивания, обработанная NiCl 2 , значительно отличалась от таковой для необработанных клеток ( p = 0.0006). Все остальные временные шкалы существенно не отличались (NS, p > 0,05). e Относительная встречаемость механических режимов реакции раны в зависимости от режима ранения и условий лечения (Всего N = 25–31 клеток на экспериментальную группу). f Фракция NiCl 2 — обработанные клетки зажили, используя анализ заживления ран.
Данные для каждого условия обработки объединены из режимов 1 и 2; отдельные клетки показаны точками (контроль: N = 16–21 клеток на моду; NiCl 2 : N = 6–22 клетки на моду; KI: N = 8–19 клеток на моду). Временные шкалы измеряли, как описано в разделе «Визуализация движения клеток после ранения». Значения значимости были получены из нескольких тестов t для обработанных клеток по сравнению с необработанными клетками, α = 0,05. Только временная шкала скручивания/вытягивания, обработанная NiCl 2 , значительно отличалась от таковой для необработанных клеток ( p = 0.0006). Все остальные временные шкалы существенно не отличались (NS, p > 0,05). e Относительная встречаемость механических режимов реакции раны в зависимости от режима ранения и условий лечения (Всего N = 25–31 клеток на экспериментальную группу). f Фракция NiCl 2 — обработанные клетки зажили, используя анализ заживления ран. Данные показаны как средние (звездочки) N ≥ 3 биологических повторов (точки) и соответствуют однофазной экспоненциальной функции с использованием средних точек данных в дополнение к 24-часовой (86 400 s) выживаемости, чтобы облегчить экстраполяцию.Кривые без лечения (PSW) включены для сравнения. Контрольная линия показывает среднюю долю необработанных контрольных клеток, обработанных NiCl 2 , ниже порога I , а заштрихованная область указывает SD (3 биологических повтора). Всего N = 26–59 клеток на экспериментальные условия. Выживаемость г NiCl 2 клеток, обработанных и ч клеток, обработанных KI. Данные для неповрежденных контрольных клеток, через 24 часа после промывания, и клеток, обработанных в режиме 1 или 2, через 24 часа после повреждения, показаны как среднее (столбец) из 3 биологических повторов (точки) ( N = 15–47 клеток на повтор)
Данные показаны как средние (звездочки) N ≥ 3 биологических повторов (точки) и соответствуют однофазной экспоненциальной функции с использованием средних точек данных в дополнение к 24-часовой (86 400 s) выживаемости, чтобы облегчить экстраполяцию.Кривые без лечения (PSW) включены для сравнения. Контрольная линия показывает среднюю долю необработанных контрольных клеток, обработанных NiCl 2 , ниже порога I , а заштрихованная область указывает SD (3 биологических повтора). Всего N = 26–59 клеток на экспериментальные условия. Выживаемость г NiCl 2 клеток, обработанных и ч клеток, обработанных KI. Данные для неповрежденных контрольных клеток, через 24 часа после промывания, и клеток, обработанных в режиме 1 или 2, через 24 часа после повреждения, показаны как среднее (столбец) из 3 биологических повторов (точки) ( N = 15–47 клеток на повтор)
Дополнительный файл 6. Мембранеллярные ленточные реснички, нераненная контрольная клетка.
Дополнительный файл 7. Мембранеллярные полоски ресничек, пораненная контрольная клетка
Сначала мы проверили эффект обработки NiCl 2 . Мы подтвердили, что обработка NiCl 2 подавляла биение ресничек в нераненых клетках ( N = 6 клеток) и что подавление сохранялось после ранения ( N = 6 клеток), о чем свидетельствует отсутствие движения на кимографе и отсутствие четкой волновой картины на двумерной автокорреляции (рис.4b, c, дополнительный файл 8–9: фильмы S2c – d). Соответственно, в клетках, обработанных NiCl 2 , скручивание/натяжение реже наблюдалось в клетках, обработанных NiCl 2 (~ 20% в режиме 2, N = 6/29 клеток) по сравнению с необработанными клетками (~ 60% в режиме 2). , N = 18/31 кл.) (рис. 4д). Когда в клетке, обработанной NiCl 2 , возникал режим скручивания/вытягивания, поврежденной клетке требовалось значительно больше времени (~ 3 раза дольше), чтобы отделиться от экструдированной цитоплазмы по сравнению с необработанными клетками ( p = 0. 0006) (рис. 4г). Лечение NiCl 2 оказало незначительное влияние на другие способы реакции раны, сокращение ( p = 0,84) и восстановление цитоплазмы ( p = 0,84). Эти результаты показали, что движение ресничек в первую очередь ответственно за скручивание и тянущее движение. По сравнению с ~ 10% необработанных контрольных клеток в Режиме 2, ~ 30% клеток, обработанных NiCl 2 в Режиме 2 (клетки N = 9/29), по-видимому, не использовали механический способ реакции раны.В режиме 2, в то время как время заживления раны, оцененное с помощью анализа восстановления раны, оставалось ~ 1000 с (рис. 4f), средняя выживаемость клеток, обработанных NiCl 2 , была значительно снижена до 20% (рис. 4g) по сравнению с до 70% для необработанных клеток (рис. 1H). Выживаемость нераненых клеток, обработанных NiCl 2 , не изменилась (100% выживаемость) (фиг. 4g). Средняя выживаемость клеток, обработанных NiCl 2 , в режиме 1 составила 67% по сравнению с 96% для необработанных клеток (рис.
0006) (рис. 4г). Лечение NiCl 2 оказало незначительное влияние на другие способы реакции раны, сокращение ( p = 0,84) и восстановление цитоплазмы ( p = 0,84). Эти результаты показали, что движение ресничек в первую очередь ответственно за скручивание и тянущее движение. По сравнению с ~ 10% необработанных контрольных клеток в Режиме 2, ~ 30% клеток, обработанных NiCl 2 в Режиме 2 (клетки N = 9/29), по-видимому, не использовали механический способ реакции раны.В режиме 2, в то время как время заживления раны, оцененное с помощью анализа восстановления раны, оставалось ~ 1000 с (рис. 4f), средняя выживаемость клеток, обработанных NiCl 2 , была значительно снижена до 20% (рис. 4g) по сравнению с до 70% для необработанных клеток (рис. 1H). Выживаемость нераненых клеток, обработанных NiCl 2 , не изменилась (100% выживаемость) (фиг. 4g). Средняя выживаемость клеток, обработанных NiCl 2 , в режиме 1 составила 67% по сравнению с 96% для необработанных клеток (рис. 4g и 1H), что было меньшим снижением выживаемости, чем в режиме 2.Неожиданно в режиме 1 время заживления ран для клеток, обработанных NiCl 2 , по оценке анализа восстановления раны, значительно увеличилось с ~ 100 до ~ 1000 с (рис. 4f), что могло быть связано с целевые эффекты или токсичность Ni 2+ . Индивидуальная интенсивность флуоресценции окрашенных Sytox клеток в разные моменты времени показана в дополнительном файле 1: рис. S2. В целом, эти результаты подтверждают, что движение ресничек является ключевым компонентом процесса заживления ран в Stentor .
4g и 1H), что было меньшим снижением выживаемости, чем в режиме 2.Неожиданно в режиме 1 время заживления ран для клеток, обработанных NiCl 2 , по оценке анализа восстановления раны, значительно увеличилось с ~ 100 до ~ 1000 с (рис. 4f), что могло быть связано с целевые эффекты или токсичность Ni 2+ . Индивидуальная интенсивность флуоресценции окрашенных Sytox клеток в разные моменты времени показана в дополнительном файле 1: рис. S2. В целом, эти результаты подтверждают, что движение ресничек является ключевым компонентом процесса заживления ран в Stentor .
Дополнительный файл 8. Мембранеллярные ленточные реснички, нескрученные NiCl 2 — обработанная клетка
Дополнительный файл 9. Мембранеллярные ленточные реснички, рана NiCl 2 — обработанная клетка
Для дальнейшего исследования того, была ли реакция скручивания/вытягивания побочным продуктом связывания пролитой цитоплазмы с твердым субстратом, мы собрали поврежденные клетки в водную каплю, взвешенную во фторированном масле (с плотностью 1855 кг/м 3 ). Пролитая цитоплазма не прилипла к этой границе раздела жидкость-жидкость (L-L), образованной между водой и маслом (дополнительный файл 1: рис. S4a). Мы отмечаем, что типичные обработки поверхности для блокировки связывания (например, покрытие BSA, Pluronic F-68) не были успешными в блокировании прилипания большого количества пролитой цитоплазмы к стеклу и микрофлюидному устройству PDMS. В системе LL мы обнаружили, что большинство необработанных клеток, которые имели большое количество пролитой цитоплазмы, все еще были способны выполнять режимы ответа на скручивание/вытягивание ( N = 16 из 17 клеток, у которых было большое количество пролившейся цитоплазмы), но им потребовалось примерно в 3 раза дольше, чем необработанные клетки в микрофлюидном устройстве ( p = 0.0055) (Дополнительный файл 1: рис. S4b). Показатели выживаемости необработанных клеток, раненых или нераненых, в системе L-L были аналогичны показателям в системе твердое-жидкое (SL), где клетки собирали в чашку Петри из полистирола (дополнительный файл 1: рис.
Пролитая цитоплазма не прилипла к этой границе раздела жидкость-жидкость (L-L), образованной между водой и маслом (дополнительный файл 1: рис. S4a). Мы отмечаем, что типичные обработки поверхности для блокировки связывания (например, покрытие BSA, Pluronic F-68) не были успешными в блокировании прилипания большого количества пролитой цитоплазмы к стеклу и микрофлюидному устройству PDMS. В системе LL мы обнаружили, что большинство необработанных клеток, которые имели большое количество пролитой цитоплазмы, все еще были способны выполнять режимы ответа на скручивание/вытягивание ( N = 16 из 17 клеток, у которых было большое количество пролившейся цитоплазмы), но им потребовалось примерно в 3 раза дольше, чем необработанные клетки в микрофлюидном устройстве ( p = 0.0055) (Дополнительный файл 1: рис. S4b). Показатели выживаемости необработанных клеток, раненых или нераненых, в системе L-L были аналогичны показателям в системе твердое-жидкое (SL), где клетки собирали в чашку Петри из полистирола (дополнительный файл 1: рис. S4c).
S4c).
В клетках, обработанных NiCl 2 , скручивание/вытягивание наблюдалось реже, когда клетки собирали в системе LL ( N = 1 из 19 клеток, которые имели большое количество пролитой цитоплазмы) по сравнению с клетками в микрофлюидной системе. устройство (дополнительный файл 1: рис.С4б). Выживаемость клеток, обработанных NiCl 2 и поврежденных по Режиму 2, была одинаковой в системах SL и L-L ( p = 0,3403). Однако выживаемость обработанных NiCl 2 неповрежденных клеток и клеток, поврежденных режимом 1, была ниже в системе L-L, чем в системе SL. (Дополнительный файл 1: рис. S4c).
Во-вторых, мы проверили эффект лечения KI. Прокалывание необработанных и нераненых клеток стеклянной иглой вызывало быстрое сокращение клеток в течение ~ 20 мс [28, 31, 32, 40]. Мы подтвердили, что неповрежденные клетки, обработанные KI, не сокращались при протыкании, что позволяет предположить, что сокращение мионемы было успешно ингибировано (дополнительные файлы 10 и 11: фильмы S3a-b). Выживаемость клеток, обработанных KI, была очень низкой — около 25 % для неповрежденных контрольных клеток и 0 % для клеток с режимом 1 и 2 (рис. 4h), что исключало использование нашего анализа заживления ран на клетках, обработанных KI (все клетки отмывали после обработки KI). Мембранная полоса нераненых клеток, обработанных KI, оставалась активной и сокращалась со средней скоростью распространения волны ~ 0,91 ± 0,20 мм/с и частотой биения ресничек ~ 21,0 ± 5,2 Гц ( N = 6 клеток), что не было значимо снижен по сравнению с неповрежденными и необработанными контрольными клетками (скорость волны p = 0.105; частота ударов p = 0,47). В обработанных KI клетках, поврежденных в режиме 2, мембранная полоса билась со средней скоростью распространения волны ~ 1,18 ± 0,60 мм/с и частотой биений ресничек ~ 21,9 ± 4,0 Гц ( N = 6 клеток). По сравнению с гладкими краями полос в 2D-автокорреляции необработанных контрольных клеток, указывающих на высокую координацию, полосы клеток, обработанных KI, имели шероховатые, нечеткие края и разрывы, указывающие на небольшую потерю координации (рис.
Выживаемость клеток, обработанных KI, была очень низкой — около 25 % для неповрежденных контрольных клеток и 0 % для клеток с режимом 1 и 2 (рис. 4h), что исключало использование нашего анализа заживления ран на клетках, обработанных KI (все клетки отмывали после обработки KI). Мембранная полоса нераненых клеток, обработанных KI, оставалась активной и сокращалась со средней скоростью распространения волны ~ 0,91 ± 0,20 мм/с и частотой биения ресничек ~ 21,0 ± 5,2 Гц ( N = 6 клеток), что не было значимо снижен по сравнению с неповрежденными и необработанными контрольными клетками (скорость волны p = 0.105; частота ударов p = 0,47). В обработанных KI клетках, поврежденных в режиме 2, мембранная полоса билась со средней скоростью распространения волны ~ 1,18 ± 0,60 мм/с и частотой биений ресничек ~ 21,9 ± 4,0 Гц ( N = 6 клеток). По сравнению с гладкими краями полос в 2D-автокорреляции необработанных контрольных клеток, указывающих на высокую координацию, полосы клеток, обработанных KI, имели шероховатые, нечеткие края и разрывы, указывающие на небольшую потерю координации (рис. 4b, c, дополнительные файлы). 12 и 13: Фильмы S2e – f).Мы заметили, что лечение KI, предназначенное для ингибирования мионемы, может также влиять на мембранную полосу. Примерно в 45% клеток, обработанных KI, мембранная полоса будет ингибирована, и биение не будет заметно глазом (3 биологических повтора, N = 18–24 клеток на повтор). Это ингибирование может быть связано с частичной анестезией ресничек ионами калия [41]. Иодид-ионы также могут играть роль в ингибировании мембранной полосы, так как ранее сообщалось, что NaI ингибирует мембранную полосу в Stentor , хотя KI не обсуждался [41].Тем не менее, реснички тела клеток, обработанных KI, качественно оставались такими же активными, как и необработанные контрольные клетки, по сравнению с неактивными ресничками тела клеток, обработанных NiCl 2 , как в нераненых, так и в раненых клетках ( N = 6 клеток для каждого состояния ) (Дополнительный файл 14: фильм S2g, дополнительный файл 15: фильм S2h). Эти результаты подтвердили, что клетки, обработанные KI, сохраняли активно бьющиеся и скоординированные реснички.
4b, c, дополнительные файлы). 12 и 13: Фильмы S2e – f).Мы заметили, что лечение KI, предназначенное для ингибирования мионемы, может также влиять на мембранную полосу. Примерно в 45% клеток, обработанных KI, мембранная полоса будет ингибирована, и биение не будет заметно глазом (3 биологических повтора, N = 18–24 клеток на повтор). Это ингибирование может быть связано с частичной анестезией ресничек ионами калия [41]. Иодид-ионы также могут играть роль в ингибировании мембранной полосы, так как ранее сообщалось, что NaI ингибирует мембранную полосу в Stentor , хотя KI не обсуждался [41].Тем не менее, реснички тела клеток, обработанных KI, качественно оставались такими же активными, как и необработанные контрольные клетки, по сравнению с неактивными ресничками тела клеток, обработанных NiCl 2 , как в нераненых, так и в раненых клетках ( N = 6 клеток для каждого состояния ) (Дополнительный файл 14: фильм S2g, дополнительный файл 15: фильм S2h). Эти результаты подтвердили, что клетки, обработанные KI, сохраняли активно бьющиеся и скоординированные реснички.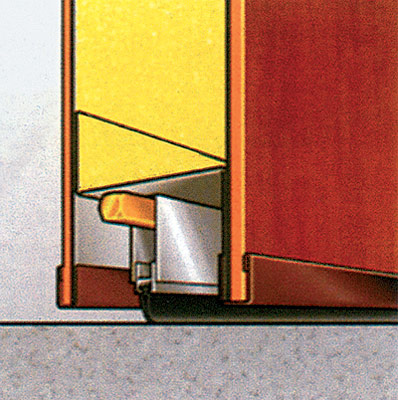
Доп. файл 10. Сокращение мионемы в контрольной клетке.
Дополнительный файл 11. Сокращение мионемы в клетке, обработанной KI.
Дополнительный файл 12. Мембранеллярные ленточные реснички, необмотанные клетки, обработанные KI
Доп. файл 13. Мембранеллярные ленточные реснички, поврежденные клетки, обработанные KI
Доп. файл 14. Реснички тела незакрученных клеток.
Доп. файл 15. Реснички тела раненых клеток.
На рисунке 4d показано, что временные шкалы для всех трех режимов ответа в клетках, обработанных KI, незначительно отличались от необработанных контролей (сокращение p = 0,86; извлечение p = 0,13; скручивание/вытягивание p = 0,9). В обоих режимах 1 и 2 клетки, обработанные KI, чаще использовали только сокращение в ответ на рану (режим 1, N = 16/25 клеток; режим 2, N = 8/27 клеток) по сравнению с необработанными контрольными клетками. (режим 1, N = 10/26 клеток; режим 2, N = 3/31 клеток), тогда как режим извлечения цитоплазмы и режим скручивания/вытягивания встречались реже (рис.4д). Эти результаты показывают, что активные мионемы не являются необходимыми для режима реакции сокращения, но могут играть роль в режимах извлечения цитоплазмы и скручивания/натяжения. Наконец, во всех случаях лечения как биение мембранной полосы (измеренное с помощью 2D-автокорреляции), так и ресничек тела (качественно сравниваемое) не подвергались сильному влиянию ранения.
(режим 1, N = 10/26 клеток; режим 2, N = 3/31 клеток), тогда как режим извлечения цитоплазмы и режим скручивания/вытягивания встречались реже (рис.4д). Эти результаты показывают, что активные мионемы не являются необходимыми для режима реакции сокращения, но могут играть роль в режимах извлечения цитоплазмы и скручивания/натяжения. Наконец, во всех случаях лечения как биение мембранной полосы (измеренное с помощью 2D-автокорреляции), так и ресничек тела (качественно сравниваемое) не подвергались сильному влиянию ранения.
Срез | Ур.1 | Владение оружием | Мгновенное | 2,5 с | — | 3 года 0 лет | Атака с силой 300. Дополнительный эффект: Увеличивает шкалу души на 10.  | |
Срез для воска | Ур.5 | Владение оружием | Мгновенное | 2,5 с | — | 3 года 0 лет | Обеспечивает атаку с силой 140. Действие комбо: Разрез Сила комбо: 380 Бонус комбо: Увеличивает шкалу души на 10 | |
Тень Смерти | Ур.10 | Владение оружием | Мгновенное | 2,5 с | — | 3 года 0 лет | Наносит атаку с силой 300. Дополнительный эффект: Поражает цель Замыслом Смерти, увеличивая наносимый вами урон на 10%.  Продолжительность: 30 с Увеличивает время действия Замысла Смерти на 30 с, максимум до 60 с. Дополнительный эффект: Увеличивает шкалу души на 10, если цель нокаутирована до истечения срока действия эффекта. | |
Харпе | Ур.15 | Заклинание | 1,3 с | 2,5 с | — | 25 лет 0 лет | Наносит неаспектированный урон с силой 300. | |
Вход в ад | Ур.20 | Способность | Мгновенное | 20 с | — | 0 лет 0 лет | Быстро мчитесь вперед на 15 ярдов. Дополнительный эффект: Позволяет немедленно использовать следующую Харпу. Продолжительность: 15 с. Дополнительный эффект: Оставляет Врата Ада в исходной точке и дает себе Порог. Продолжительность: 10 с. Тот же таймер повторного применения, что и у Hell’s Egress. | |
Адский выход | Ур. 20 | Способность | Мгновенное | 20 с | — | 0 лет 0 лет | Быстро сделать 15 ярдов назад. Дополнительный эффект: Позволяет немедленно использовать следующую Харпу. Продолжительность: 15 с. Дополнительный эффект: Оставляет Врата Ада в исходной точке и дает себе Порог. Продолжительность: 10 с. Тот же таймер повторного применения, что и у Hell’s Ingress. | |
Вращающаяся коса | Ур. | Владение оружием | Мгновенное | 2,5 с | — | 0 лет 5 лет | Наносит атаку с силой 140 всем ближайшим врагам. Дополнительный эффект: увеличивает шкалу души на 10 | |
Адский ломтик | Ур.30 | Владение оружием | Мгновенное | 2,5 с | — | 3 года 0 лет | Обеспечивает атаку с силой 140. Комбо-действие: Растущий ломтик Сила комбо: 460 Бонус комбо: Увеличивает шкалу души на 10 | |
Завиток смерти | Ур. | Владение оружием | Мгновенное | 2,5 с | — | 0 лет 5 лет | Наносит атаку с силой 100 всем ближайшим врагам. Дополнительный эффект: Поражает цель Замыслом Смерти, увеличивая наносимый вами урон на 10%. Продолжительность: 30 с Продлевает время действия Замысла Смерти на 30 с, максимум до 60 с. Дополнительный эффект: Увеличивает шкалу души на 10, если цель нокаутирована до истечения срока действия эффекта. | |
Чародейский герб | Ур.40 | Способность | Мгновенное | 30 с | — | 0 лет 0 лет | Дает Crest of Time Borrowed самому себе, создавая барьер, который сводит на нет урон в размере до 10% от максимального HP. Продолжительность: 5 с Дарует Гребень времени Возвращается себе и ближайшим членам группы в радиусе 15 йалмов, когда барьер полностью поглощается. Crest of Time Return Эффект: постепенно восстанавливает HP Cure Potency: 50 Продолжительность: 15 с | |
Кошмарная коса | Ур. 45 | Владение оружием | Мгновенное | 2,5 с | — | 0 лет 5 лет | Наносит атаку с силой 120 всем ближайшим врагам. Комбо-действие: Вращающаяся коса Сила комбо: 180 Бонус комбо: Увеличивает шкалу души на 10 | |
Кровавый стебель | Ур. | Способность | Мгновенное | 1с | — | 3 года 0 лет | Призывает вашего аватара для атаки с силой 340. Дополнительный эффект: Предоставляет Soul Reaver Продолжительность: 30 с Количество стеков будет уменьшено до 1, когда уже находится под действием Soul Reaver. Soul Gauge Стоимость: 50 Общий таймер повторного применения для всех атак аватара, кроме Чревоугодия. ※ Действие меняется на «Кусочек Лемура» под действием «Окутывания». | |
Мрачная полоса | Ур.55 | Способность | Мгновенное | 1с | — | 8 лет 8 лет | Призывает вашего аватара для атаки с силой 140 по всем врагам в конусе перед вами. Дополнительный эффект: Предоставляет Soul Reaver Продолжительность: 30 с Количество стеков будет уменьшено до 1, когда уже находится под действием Soul Reaver. Soul Gauge Стоимость: 50 Общий таймер повторного применения для всех атак аватара, кроме Чревоугодия. ※ Действие меняется на Косу Лемура под действием Enshrouded. | |
Кусочек души | Ур. 60 | Владение оружием | Мгновенное | 30 с | — | 3 года 0 лет | Атака с силой 460. Дополнительный эффект: Увеличивает шкалу души на 50. Максимальное количество зарядов: 2. Имеет общий таймер повторного применения с Soul Scythe. | |
Коса души | Ур. | Владение оружием | Мгновенное | 30 с | — | 0 лет 5 лет | Наносит атаку с силой 180 всем ближайшим врагам. Дополнительный эффект: Увеличивает шкалу души на 50 Максимальное количество зарядов: 2 Имеет общий таймер повторного применения с Soul Slice. | |
Виселица | Ур. 70 | Владение оружием | Мгновенное | 2,5 с | — | 3 года 0 лет | Атака с силой 400. 460 при исполнении с фланга цели. Enhanced Gibbet Potency: 460 Flank Enhanced Potency: 520 Дополнительный эффект: Предоставляет Enhanced Gallows Продолжительность: 60 с Действие Blood Steak меняется на Unveiled Gallows под действием Enhanced Gallows.  Дополнительный эффект: Увеличивает шкалу Плащаницы на 10. Может выполняться только под действием Soul Reaver. ※ Действие меняется на Жатва Бездны под действием Enshrouded. | |
Виселица | Ур.70 | Владение оружием | Мгновенное | 2,5 с | — | 3 года 0 лет | Выполняет атаку с силой 400. 460 при выполнении из тыла цели. Улучшенная виселица Мощность: 460 Задняя часть Усиленная мощность: 520 Дополнительный эффект: Предоставляет улучшенную виселицу Продолжительность: 60 с Действие «Кровавый стебель» меняется на «Открытая виселица» под действием «Улучшенной виселицы». Дополнительный эффект: Увеличивает шкалу Плащаницы на 10. Может выполняться только под действием Soul Reaver. 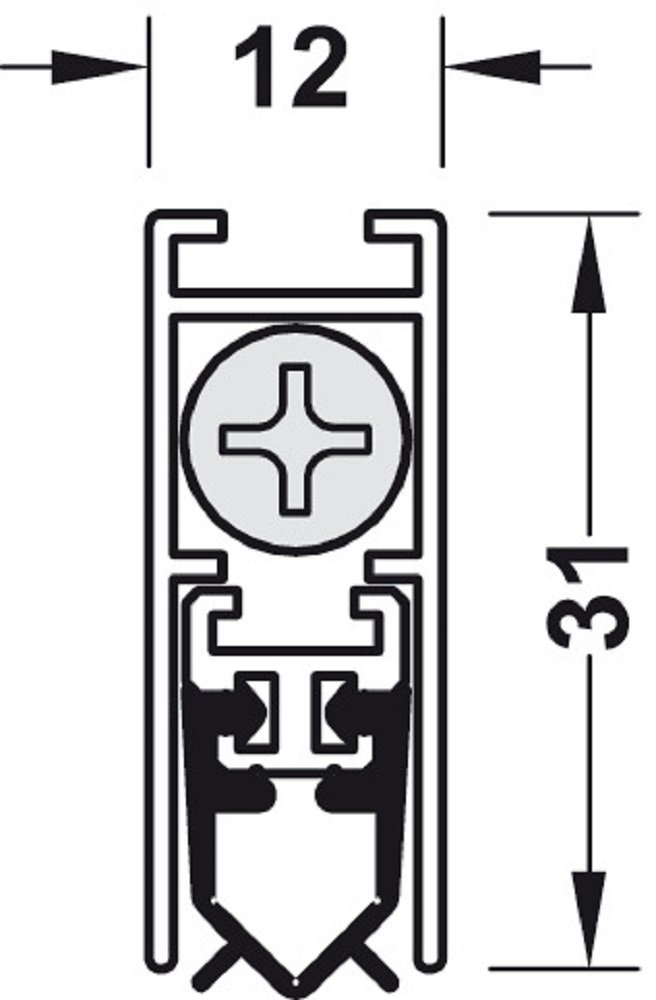 ※Действие меняется на перекрестную жатву под действием Enshrouded. | |
Гильотина | Ур. 70 | Владение оружием | Мгновенное | 2.5с | — | 8 лет 8 лет | Наносит атаку силой 200 всем врагам в конусе перед вами. Дополнительный эффект: Увеличивает шкалу Плащаницы на 10. Может выполняться только под действием Soul Reaver. ※ Действие меняется на Мрачная жатва под действием Enshrouded. | |
Открытая виселица | Ур.70 | Способность | Мгновенное | 1с | — | 3 года 0 лет | Призывает вашего аватара для атаки с силой 400. Дополнительный эффект: Предоставляет Soul Reaver Продолжительность: 30 с Количество стеков будет уменьшено до 1, когда вы уже находитесь под действием Soul Reaver. Soul Gauge Стоимость: 50 Может быть выполнено только под действием Enhanced Gibbet. Общий таймер повторного применения со всеми атаками аватара, кроме Чревоугодия. ※Это действие нельзя назначить панели быстрого доступа. | |
Открытая виселица | Ур. 70 | Способность | Мгновенное | 1с | — | 3 года 0 лет | Призывает вашего аватара для атаки с силой 400. Дополнительный эффект: Предоставляет Soul Reaver Продолжительность: 30 с Количество стеков будет уменьшено до 1, когда уже находится под действием Soul Reaver.  Soul Gauge Стоимость: 50 Может быть выполнено только под действием Enhanced Gallows. Общий таймер повторного применения со всеми атаками аватара, кроме Чревоугодия. ※Это действие нельзя назначить панели быстрого доступа. | |
Чародейский круг | Ур.72 | Способность | Мгновенное | 120 с | — | 0 лет 15 лет | Увеличивает урон, наносимый вами и ближайшими членами группы, на 3%. Длительность: 20 с Дополнительный эффект: Дарует круг жертвоприношения себе и ближайшим членам группы Продолжительность: 5 с Дополнительный эффект: Дарует круг кровопролития себе Продолжительность: 6 с Круг жертвоприношения Эффект: когда вы или члены группы успешно попадаете под этот эффект применив оружейный навык или произнеся заклинание, жнец, который его применил, может получить стек Бессмертной жертвы, максимум до 8 Длительность: 30 с Круг крови Эффект: Позволяет вам накапливать стаки Бессмертной жертвы от членов группы под эффект вашего круга жертвоприношения | |
Регресс | Ур. | Способность | Мгновенное | 10 с | — | 30 лет 0 лет | Мгновенно переместитесь к оставленным вами вратам ада. Может выполняться только под действием Порога. Невозможно выполнить в связанном состоянии. ※Это действие нельзя назначить панели быстрого доступа. | |
Чревоугодие | Ур.76 | Способность | Мгновенное | 60-е годы | — | 25 лет 5 лет | Призывает вашего аватара для нанесения неаспектированного урона цели и всем врагам поблизости с силой 500 для первого врага и на 25% меньше для всех остальных врагов. Дополнительный эффект: дает 2 стека Soul Reaver Продолжительность: 30 с Soul Gauge Стоимость: 50 | |
Ур. | Способность | Мгновенное | 15 с | — | 0 лет 0 лет | Предлагает вашу плоть в качестве сосуда для вашего аватара, получая максимальное количество зарядов Lemure Shroud. Продолжительность: 30 с. Определенные действия не могут быть выполнены, когда вы играете хостом своего аватара. Датчик кожуха Стоимость: 50 | ||
Жатва Пустоты | Ур.80 | Владение оружием | Мгновенное | 1,5 с | — | 3 года 0 лет | Обеспечивает атаку силой 460. Enhanced Void Reaping Потенциал: 520 Дополнительный эффект: Предоставляет Enhanced Cross Reaping Продолжительность: 30 с Дополнительный эффект: Предоставляет Void Shroud Может быть выполнен только под действием Enshrouded.  На таймер повторного применения не могут влиять статусные эффекты или атрибуты снаряжения. Lemure Shroud Стоимость: 1 ※Это действие нельзя назначить на панель быстрого доступа. | |
Крестовая жатва | Ур. 80 | Владение оружием | Мгновенное | 1.5с | — | 3 года 0 лет | Обеспечивает атаку силой 460. Enhanced Cross Reaping Потенциал: 520 Дополнительный эффект: Предоставляет Enhanced Void Reaping Продолжительность: 30 с Дополнительный эффект: Предоставляет Void Shroud Может быть выполнен только под действием Lemure Shroud. На таймер повторного применения не могут влиять статусные эффекты или атрибуты снаряжения. Lemure Shroud Стоимость: 1 ※Это действие нельзя назначить на панель быстрого доступа. | |
Мрачная жатва | Ур. 80 | Владение оружием | Мгновенное | 1,5 с | — | 8 лет 8 лет | Наносит атаку силой 200 всем врагам в конусе перед вами. Дополнительный эффект: Дает Void Shroud Может быть выполнен только под эффектом Enshrouded. На таймер повторного применения не могут влиять статусные эффекты или атрибуты снаряжения. Lemure Shroud Стоимость: 1 ※Это действие нельзя назначить на панель быстрого доступа. | |
Поросенок душ | Ур.82 | Заклинание | 5с | 2,5 с | — | 0 лет 0 лет | Дарует Soulsow себе, изменяя действие на Harvest Moon. Время произнесения заклинания мгновенное при использовании вне боя. | |
Урожайная луна | Ур.82 | Заклинание | Мгновенное | 2,5 с | — | 25 лет 5 лет | Наносит неаспектированный урон цели и всем врагам рядом с ней с силой 600 для первого врага и на 50% меньше для всех остальных врагов. Можно выполнить только под действием Soulsow. ※Это действие нельзя назначить панели быстрого доступа. | |
Кусочек Лемура | Ур.86 | Способность | Мгновенное | 1с | — | 3 года 0 лет | Атака с силой 200. Void Shroud Стоимость: 2 Имеет общий таймер повторного применения с Косой Лемура. ※Это действие нельзя назначить панели быстрого доступа. | |
Коса Лемура | Ур.86 | Способность | Мгновенное | 1с | — | 8 лет 8 лет | Наносит атаку силой 100 всем врагам в конусе перед вами. Void Shroud Стоимость: 2 Имеет общий таймер повторного применения с Lemure’s Slice. ※Это действие нельзя назначить панели быстрого доступа. | |
Обильный урожай | Ур.88 | Владение оружием | Мгновенное | 2,5 с | — | 15 лет 15 лет | Наносит атаку всем врагам на прямой перед вами с силой 520 для первого врага и на 60% меньше для всех остальных врагов. Immortal Sacrifice Стоимость: 1 стек Эффективность увеличивается до 800, когда количество стак Immortal Sacrifice превышает минимальную стоимость. Дополнительный эффект: Увеличивает шкалу Плащаницы на 50. Не может быть выполнено под действием Bloodsown Circle. При выполнении поглощает все стаки Immortal Sacrifice. | |
Причастие | Ур. 90 | Заклинание | 1.3с | 2,5 с | — | 25 лет 5 лет | Наносит неаспектированный урон цели и всем врагам рядом с ней с силой 1000 для первого врага и на 60% меньше для всех остальных врагов. Эффект Enshroud перестает действовать после выполнения. Для выполнения требуется как минимум один стек Lemure Shroud. | |
Эвристика ныряния на основе шаблонов для двумерной гильотинной задачи раскроя с остатками
https://doi. org/10.1007/s13675-019-00113-9Получить права и содержимое
org/10.1007/s13675-019-00113-9Получить права и содержимое
Abstract
В двумерной задаче о раскрое на гильотине цель состоит в том, чтобы минимизировать количество больших пластин, используемых для разрезания списка маленьких прямоугольников. Рассмотрен вариант этой задачи, возникающий в стекольной промышленности при последовательном рассмотрении различных накладных (или партий). Из практических организационных соображений остатки не используются повторно, за исключением большого, полученного в последней схеме раскроя партии, который можно повторно использовать для следующей партии.Задача может быть разложена на независимую задачу для каждой партии. В этой статье мы сосредоточимся на задаче с одной партией, цель которой состоит в том, чтобы минимизировать общую ширину используемых схем раскроя. Мы предлагаем эвристику погружения, основанную на генерации столбцов, в которой проблема ценообразования решается с помощью динамического программирования (DP). Эта ДП генерирует так называемые неправильные столбцы, т. е. шаблоны раскроя, которые не могут участвовать в допустимом целочисленном решении задачи. Мы покажем, как адаптировать стандартную эвристику дайвинга к этому «неправильному» случаю, сохранив при этом ее эффективность.Мы также вводим метод частичного перечисления, который предназначен для уменьшения количества неправильных шаблонов в пространстве решений динамической программы. Этот метод усиливает нижние границы, полученные путем генерации столбцов, и улучшает качество решений, найденных эвристикой погружения. Результаты вычислений сообщаются и сравниваются с классическими тестами из литературы, а также с новыми экземплярами, основанными на данных стекольной промышленности. Согласно этим результатам, варианты предложенной эвристики ныряния превосходят конструктивную и эволюционную эвристики.
е. шаблоны раскроя, которые не могут участвовать в допустимом целочисленном решении задачи. Мы покажем, как адаптировать стандартную эвристику дайвинга к этому «неправильному» случаю, сохранив при этом ее эффективность.Мы также вводим метод частичного перечисления, который предназначен для уменьшения количества неправильных шаблонов в пространстве решений динамической программы. Этот метод усиливает нижние границы, полученные путем генерации столбцов, и улучшает качество решений, найденных эвристикой погружения. Результаты вычислений сообщаются и сравниваются с классическими тестами из литературы, а также с новыми экземплярами, основанными на данных стекольной промышленности. Согласно этим результатам, варианты предложенной эвристики ныряния превосходят конструктивную и эволюционную эвристики.
Ключевые слова
ключевые слова
Резка и упаковка
Динамическое программирование
Генерация колонна
Дайвинг Eururistic
Математика Тема
Математика Тема
9000B30
9000B80B30B30
90B80
90C27
90C39
Рекомендуемое соревнование Статьи (0)
Посмотреть полный текст
Copyright © 2019 Автор(ы). Опубликовано Elsevier B.V. от имени Ассоциации европейских обществ операционных исследований (EURO).Издано Elsevier Ltd
Опубликовано Elsevier B.V. от имени Ассоциации европейских обществ операционных исследований (EURO).Издано Elsevier Ltd
Рекомендованные статьи
Ссылки на статьи
Распространение технологий во время революций
Автор
Перечислено:
- Уго М. Граньолат
(Школа повышения квалификации Сант-Анна, Piazza Martiri della libertá 33, 56127, Пиза, Италия)
- Daniele Moschella
(Школа повышения квалификации Сант-Анна, Piazza Martiri della libertá 33, 56127, Пиза, Италия)
- Emanuele Pugliese
(Школа повышения квалификации Сант-Анна, Piazza Martiri della libertá 33, 56127, Пиза, Италия)
Abstract
Экономия от масштаба и спрос в сочетании с относительными ценами факторов производства могут дать экономическое объяснение места и времени промышленной революции.Его трудосберегающие инновации приносили прибыль только выше минимального порога выпуска, который позволял покрыть первоначальные затраты на капитал. В свою очередь возможность превышения такого порога зависела от потребительского спроса, на который влияли уровень и распределение реальных доходов. Случай с прядильной фабрикой «Дженни» и хлопчатобумажной промышленностью в Англии и Франции служит ценным примером, показывающим, какое значение могли иметь соображения масштаба и спроса даже накануне промышленной революции, подразумевая, таким образом, также потенциально важную роль распределения доходов.
В свою очередь возможность превышения такого порога зависела от потребительского спроса, на который влияли уровень и распределение реальных доходов. Случай с прядильной фабрикой «Дженни» и хлопчатобумажной промышленностью в Англии и Франции служит ценным примером, показывающим, какое значение могли иметь соображения масштаба и спроса даже накануне промышленной революции, подразумевая, таким образом, также потенциально важную роль распределения доходов.
Рекомендуемое цитирование
» Прялка Дженни и гильотина: распространение технологий во время революций ,»
Cliometrica, Журнал исторической экономики и эконометрической истории, Французская ассоциация Cliométrie (AFC), vol. 8(1), страницы 5-26, январь.
Обработчик: RePEc:afc:cliome:v:8:y:2014:i:1:p:5-26
DOI: 10.1007/s11698-012-0092-9
Скачать полный текст от издателя
Поскольку доступ к этому документу ограничен, вы можете найти другую версию ниже или найти другую его версию.
Другие версии этого товара:
Подробнее об этом изделии
Ключевые слова
Промышленная революция; Распределение доходов; Экономия за счет масштаба; Выбор техники;
Все эти ключевые слова.
Классификация JEL:
- N00 — Экономическая история — — Общие — — — Общие
- N33 — Экономическая история — — Труд и потребители, демография, образование, здравоохранение, благосостояние, доход, богатство, религия и филантропия — — — Европа: до 1913 г.
- N73 — Экономическая история — — Экономическая история: транспорт, международная и внутренняя торговля, энергетика и другие услуги — — — Европа: до 1913 г.
- O14 — экономическое развитие, инновации, технологические изменения и рост — — экономическое развитие — — — индустриализация; Производство и сфера услуг; Выбор технологии
Статистика
Доступ и загрузка статистики
Исправления
Все материалы на этом сайте предоставлены соответствующими издателями и авторами. Вы можете помочь исправить ошибки и упущения. При запросе исправления укажите дескриптор этого элемента: RePEc:afc:cliome:v:8:y:2014:i:1:p:5-26 . См. общую информацию о том, как исправить материал в RePEc.
Вы можете помочь исправить ошибки и упущения. При запросе исправления укажите дескриптор этого элемента: RePEc:afc:cliome:v:8:y:2014:i:1:p:5-26 . См. общую информацию о том, как исправить материал в RePEc.
По техническим вопросам, касающимся этого элемента, или для исправления его авторов, названия, реферата, библиографической информации или информации для загрузки, обращайтесь: . Общие контактные данные провайдера: https://edirc.repec.org/data/afcccea.html .
Если вы создали этот элемент и еще не зарегистрированы в RePEc, мы рекомендуем вам сделать это здесь.Это позволяет связать ваш профиль с этим элементом. Это также позволяет вам принимать потенциальные ссылки на этот элемент, в отношении которых мы не уверены.
У нас нет библиографических ссылок на этот элемент. Вы можете помочь добавить их, используя эту форму .
Если вы знаете об отсутствующих элементах, ссылающихся на этот, вы можете помочь нам создать эти ссылки, добавив соответствующие ссылки таким же образом, как указано выше, для каждого ссылающегося элемента. Если вы являетесь зарегистрированным автором этого элемента, вы также можете проверить вкладку «Цитаты» в своем профиле RePEc Author Service, так как некоторые цитаты могут ожидать подтверждения.
Если вы являетесь зарегистрированным автором этого элемента, вы также можете проверить вкладку «Цитаты» в своем профиле RePEc Author Service, так как некоторые цитаты могут ожидать подтверждения.
По техническим вопросам, касающимся этого элемента, или для исправления его авторов, названия, реферата, библиографической информации или информации для загрузки, обращайтесь: (адрес электронной почты доступен ниже). Общие контактные данные провайдера: https://edirc.repec.org/data/afcccea.html .
Обратите внимание, что фильтрация исправлений может занять пару недель.
различные услуги RePEc.
Микрожидкостная гильотина для исследования заживления ран одиночными клетками
Значение
В то время как ткани могут регулярно заживлять раны, все чаще признается, что отдельные клетки, включая мышечные клетки, нейроны и раковые клетки, обладают реакцией на рану.Способность понимать и контролировать восстановление одиночных клеток открывает потенциал для новых стратегий лечения заболеваний человека. Существующие методы ранения и модельные организмы недостаточны для выяснения задействованных биологических механизмов. В этой статье сообщается о микрофлюидной гильотине для воспроизводимого разделения сотен клеток пополам с высокой пропускной способностью. Достигнутое точное временное разрешение позволяет проводить механистические исследования, имеющие решающее значение для молекулярного понимания одноклеточного заживления ран, которое в настоящее время невозможно с помощью существующих методов лечения ран.Работа здесь заложит основу для понимания того, как отдельные клетки исцеляют себя, что является фундаментальной особенностью, отличающей живую материю от неживой.
Существующие методы ранения и модельные организмы недостаточны для выяснения задействованных биологических механизмов. В этой статье сообщается о микрофлюидной гильотине для воспроизводимого разделения сотен клеток пополам с высокой пропускной способностью. Достигнутое точное временное разрешение позволяет проводить механистические исследования, имеющие решающее значение для молекулярного понимания одноклеточного заживления ран, которое в настоящее время невозможно с помощью существующих методов лечения ран.Работа здесь заложит основу для понимания того, как отдельные клетки исцеляют себя, что является фундаментальной особенностью, отличающей живую материю от неживой.
Abstract
Заживление ран является ключевым признаком, отличающим живую материю от неживой. Все чаще признается, что одиночные клетки способны заживлять раны. Отсутствие воспроизводимых, высокопроизводительных методов лечения ран препятствовало исследованиям одноклеточного восстановления ран. В этой работе описывается микрожидкостная гильотина для разделения пополам одиночных клеток Stentor coeruleus в непрерывном режиме. Stentor используется в качестве модели из-за его надежной способности к восстановлению и способности выполнять нокдаун генов с высокой производительностью. Динамика локального разрезания показывает два режима, при которых клетки разрезаются пополам: один при низком вязком напряжении, когда клетки разрезаются с небольшими разрывами мембран и высокой жизнеспособностью, и другой при высоком вязком напряжении, когда клетки разрезаются с расширенными разрывами мембран и сниженной жизнеспособностью. Достигается производительность резки до 64 клеток в минуту, что более чем в 200 раз быстрее, чем при использовании существующих методов.Метод позволяет генерировать более 100 клеток на синхронизированной стадии процесса их восстановления. Эта способность в сочетании с высокопроизводительным нокдауном генов в Stentor позволяет проводить механистические исследования с течением времени, что невозможно при современных методах ранения.
Stentor используется в качестве модели из-за его надежной способности к восстановлению и способности выполнять нокдаун генов с высокой производительностью. Динамика локального разрезания показывает два режима, при которых клетки разрезаются пополам: один при низком вязком напряжении, когда клетки разрезаются с небольшими разрывами мембран и высокой жизнеспособностью, и другой при высоком вязком напряжении, когда клетки разрезаются с расширенными разрывами мембран и сниженной жизнеспособностью. Достигается производительность резки до 64 клеток в минуту, что более чем в 200 раз быстрее, чем при использовании существующих методов.Метод позволяет генерировать более 100 клеток на синхронизированной стадии процесса их восстановления. Эта способность в сочетании с высокопроизводительным нокдауном генов в Stentor позволяет проводить механистические исследования с течением времени, что невозможно при современных методах ранения.
Заживление ран является важным биологическим процессом для поддержания гомеостаза и, в конечном счете, для выживания. По сравнению с заживлением ран на уровне тканей, то, как отдельные клетки заживают раны и регенерируют поврежденные или утраченные клеточные структуры, менее изучено (1).Тем не менее, все чаще признается, что отдельные клетки, такие как мышечные клетки и нейроны, способны заживлять раны (1⇓–3). Понимание того, как отдельные клетки восстанавливают себя, имеет решающее значение для определения основных клеточных функций и, в конечном итоге, для выявления того, как развиваются заболевания, вызванные ранами, такие как мышечные дистрофии.
По сравнению с заживлением ран на уровне тканей, то, как отдельные клетки заживают раны и регенерируют поврежденные или утраченные клеточные структуры, менее изучено (1).Тем не менее, все чаще признается, что отдельные клетки, такие как мышечные клетки и нейроны, способны заживлять раны (1⇓–3). Понимание того, как отдельные клетки восстанавливают себя, имеет решающее значение для определения основных клеточных функций и, в конечном итоге, для выявления того, как развиваются заболевания, вызванные ранами, такие как мышечные дистрофии.
До сих пор исследования реакции одиночных клеток на рану проводились на нескольких модельных организмах (1, 4, 5). В частности, исследования, проведенные на ооцитах Xenopus , элегантно использовали уникальные преимущества системы ооцитов, в том числе большой размер и способность создавать и визуализировать рану в фокальной плоскости микроскопа, чтобы пролить свет на клеточные компоненты, участвующие в раневом процессе. заживление и выявить их динамические взаимодействия с помощью визуализации живых клеток. Тем не менее, как и в случае любой модельной системы, ооцитов Xenopus лучше подходят для одних типов экспериментов, чем для других. Например, ооциты транскрипционно неактивны и предварительно загружены большими запасами мРНК; таким образом, они не являются хорошей системой для исследования транскрипционной реакции на ранение. Чтобы помешать продукции белка в ооцитах Xenopus , вводят олигонуклеотиды морфолино, чтобы ингибировать трансляцию мРНК, чтобы предотвратить продукцию белка (6). Этот метод является дорогостоящим из-за высокой стоимости синтеза морфолиноолигонуклеотидов.Необходимость вводить клетки по одной также ограничивает пропускную способность подхода. Кроме того, поскольку ооциты загружены белком материнского происхождения, истощение белка может быть неполным, даже если трансляция полностью заблокирована. Кроме того, потенциальная проблема заключается в том, что процесс инъекции морфолино неизбежно повреждает клетки. К тому времени, когда проводится анализ заживления ран, клетки могут уже пройти цикл заживления ран и, следовательно, могут находиться в необычном состоянии праймирования.
Тем не менее, как и в случае любой модельной системы, ооцитов Xenopus лучше подходят для одних типов экспериментов, чем для других. Например, ооциты транскрипционно неактивны и предварительно загружены большими запасами мРНК; таким образом, они не являются хорошей системой для исследования транскрипционной реакции на ранение. Чтобы помешать продукции белка в ооцитах Xenopus , вводят олигонуклеотиды морфолино, чтобы ингибировать трансляцию мРНК, чтобы предотвратить продукцию белка (6). Этот метод является дорогостоящим из-за высокой стоимости синтеза морфолиноолигонуклеотидов.Необходимость вводить клетки по одной также ограничивает пропускную способность подхода. Кроме того, поскольку ооциты загружены белком материнского происхождения, истощение белка может быть неполным, даже если трансляция полностью заблокирована. Кроме того, потенциальная проблема заключается в том, что процесс инъекции морфолино неизбежно повреждает клетки. К тому времени, когда проводится анализ заживления ран, клетки могут уже пройти цикл заживления ран и, следовательно, могут находиться в необычном состоянии праймирования. Таким образом, существует потребность в дополнительной системе для ооцитов Xenopus , которая была бы более подходящей для высокопроизводительных подходов к нокдауну генов и анализа профилирования транскрипции.В идеале такая система должна быть совместима с простыми и экономичными методами изменения экспрессии генов, такими как РНК-интерференция путем кормления, чтобы облегчить изучение большого количества клеток без повреждения клеток в процессе изменения генов.
Таким образом, существует потребность в дополнительной системе для ооцитов Xenopus , которая была бы более подходящей для высокопроизводительных подходов к нокдауну генов и анализа профилирования транскрипции.В идеале такая система должна быть совместима с простыми и экономичными методами изменения экспрессии генов, такими как РНК-интерференция путем кормления, чтобы облегчить изучение большого количества клеток без повреждения клеток в процессе изменения генов.
Здесь мы используем Stentor coeruleus в качестве модельного организма для исследований одноклеточного заживления ран, поскольку он удовлетворяет такому требованию (7⇓–9). Stentor представляет собой одноклеточное простейшее с инфузориями длиной до 1 мм. Они существуют в виде одиночных клеток и регулярно травмируются в физиологических условиях (т.g., нападения хищников) (10) и, как известно, способны быстро восстанавливаться после тяжелых ран и регенерировать из клеточных фрагментов размером до 1/27 исходного размера клетки (11, 12). Stentor был популярным микроорганизмом в начале 1900-х годов (11), но так и не был разработан в качестве молекулярной модельной системы отчасти потому, что культивирование в больших количествах было затруднено. С появлением малозатратных инструментов секвенирования следующего поколения стало возможным разработать Stentor в качестве модельного организма.Недавно был опубликован геном Stentor (9). Мы также продемонстрировали полезность РНКи для подавления экспрессии генов путем кормления бактерий Stentor , содержащих экспрессионную плазмиду, кодирующую дцРНК, нацеленную на интересующие гены (7, 8). Таким образом, Stentor предлагает существенное техническое преимущество по сравнению с ооцитами Xenopus для высокопроизводительных нокдаун-исследований.
Stentor был популярным микроорганизмом в начале 1900-х годов (11), но так и не был разработан в качестве молекулярной модельной системы отчасти потому, что культивирование в больших количествах было затруднено. С появлением малозатратных инструментов секвенирования следующего поколения стало возможным разработать Stentor в качестве модельного организма.Недавно был опубликован геном Stentor (9). Мы также продемонстрировали полезность РНКи для подавления экспрессии генов путем кормления бактерий Stentor , содержащих экспрессионную плазмиду, кодирующую дцРНК, нацеленную на интересующие гены (7, 8). Таким образом, Stentor предлагает существенное техническое преимущество по сравнению с ооцитами Xenopus для высокопроизводительных нокдаун-исследований.
Чтобы в полной мере воспользоваться преимуществами высокопроизводительного нокдауна генов, требуется метод ранения клеток с одновременно высокой пропускной способностью.Быстрое ранение с высокой пропускной способностью также имеет решающее значение для обеспечения достаточного временного разрешения в последующих наблюдениях, потому что заживление раны по своей сути является динамическим процессом. В Stentor регенерация разделяется на серию морфологических стадий, каждая из которых занимает около 1 часа (13). Любое исследование, которое направлено на изучение механизма и временной эволюции заживления ран, потребует метода, который может генерировать большое количество поврежденных клеток в масштабе времени, который является коротким по сравнению с масштабом времени заживления, так что все клетки относительно синхронизированы во времени. их стадии процесса.К сожалению, традиционный метод ранения, основанный на ручной манипуляции стеклянными иглами, слишком медленный, чтобы удовлетворить эту потребность (14, 15). Чтобы ранить одну клетку, требуется ~ 3 мин, в зависимости от навыков экспериментатора. Получение 100 клеток заняло бы 5 часов, в течение которых уже произошло бы значительное заживление и регенерация. Кроме того, ранение групп клеток в одинаковой степени является сложной задачей, поскольку контролировать размер раны с помощью ручного разрезания сложно. Таким образом, невозможно проводить временные эксперименты, включающие такой анализ, как секвенирование РНК, для которого обычно требуются сотни клеток.
В Stentor регенерация разделяется на серию морфологических стадий, каждая из которых занимает около 1 часа (13). Любое исследование, которое направлено на изучение механизма и временной эволюции заживления ран, потребует метода, который может генерировать большое количество поврежденных клеток в масштабе времени, который является коротким по сравнению с масштабом времени заживления, так что все клетки относительно синхронизированы во времени. их стадии процесса.К сожалению, традиционный метод ранения, основанный на ручной манипуляции стеклянными иглами, слишком медленный, чтобы удовлетворить эту потребность (14, 15). Чтобы ранить одну клетку, требуется ~ 3 мин, в зависимости от навыков экспериментатора. Получение 100 клеток заняло бы 5 часов, в течение которых уже произошло бы значительное заживление и регенерация. Кроме того, ранение групп клеток в одинаковой степени является сложной задачей, поскольку контролировать размер раны с помощью ручного разрезания сложно. Таким образом, невозможно проводить временные эксперименты, включающие такой анализ, как секвенирование РНК, для которого обычно требуются сотни клеток.
Альтернативный метод с использованием лазерной абляции применялся для введения ран в другие типы клеток (16⇓⇓–19). Лазерное ранение напрямую совместимо с визуализирующим анализом, поскольку его можно проводить с помощью того же микроскопа, который используется для последующей визуализации. Однако пропускная способность относительно низка, потому что лазерное пятно необходимо перемещать и перефокусировать, чтобы ранить каждую новую клетку. Идеальный анализ заживления ран для наших целей должен вводить раны с пропускной способностью намного выше, чем это допускается традиционными методами ручного вскрытия.
В этой статье мы стремимся устранить вышеуказанные ограничения с помощью микрожидкостного гильотинного устройства для автоматизации резки клеток Stentor в непрерывном режиме. Вместо того, чтобы двигать острым предметом (например, ножом) относительно неподвижной клетки (20), мы пропускаем клетку через нож с фиксированным положением внутри микрожидкостного канала. Наша конструкция имеет два ключевых преимущества: ( i ) удержание клетки в микроканале позволяет легко позиционировать клетку на ноже, и ( ii ) облегчает обработку непрерывного потока клеток в потоке. таким образом, потому что срезанные клетки можно легко вымыть из канала.В первой демонстрации принципа мы сосредоточимся на разделении ячеек пополам. Мы отслеживаем форму клетки во время процесса резки при различных применяемых условиях потока и измеряем последующую жизнеспособность клеток. Мы считаем, что наша микрофлюидная платформа заложит основу для использования Stentor , чтобы понять, как отдельные клетки заживают раны и регенерируют.
Наша конструкция имеет два ключевых преимущества: ( i ) удержание клетки в микроканале позволяет легко позиционировать клетку на ноже, и ( ii ) облегчает обработку непрерывного потока клеток в потоке. таким образом, потому что срезанные клетки можно легко вымыть из канала.В первой демонстрации принципа мы сосредоточимся на разделении ячеек пополам. Мы отслеживаем форму клетки во время процесса резки при различных применяемых условиях потока и измеряем последующую жизнеспособность клеток. Мы считаем, что наша микрофлюидная платформа заложит основу для использования Stentor , чтобы понять, как отдельные клетки заживают раны и регенерируют.
Результаты и обсуждение
Дизайн и валидация устройства микрожидкостной гильотины.
Рис.1 A показывает схему микрожидкостного гильотинного устройства. Нож состоял из простого треугольного лезвия, изготовленного из полидиметилсилоксана (ПДМС). Клетка, введенная в микроканал, разрезалась ножом, и две половинки разрезанной клетки («фрагменты») вытекали в два выходных канала. Мы обнаружили, что нож из ПДМС был достаточно жестким и эффективным для разрезания Stentor , хотя ПДМС относительно мягкий (модуль Юнга ~500 кПа). Во всех наших экспериментах мы не наблюдали деформации самого ПДМС.Хотя мы не измеряли модуль Юнга Stentor , мы ожидаем, что его значение будет близко к значению одноклеточного Dictyostelium (∼1–8 кПа) (21), что примерно в 100 раз меньше, чем у PDMS. Для облегчения эффективного разрезания Stentor мы использовали каналы с размерами меньше размера клетки (таблица S1). Это ограничение гарантировало, что клетки будут разрезаны ножом, и предотвратило их обход ножом и попадание в один из выходов без разреза.Чтобы убедиться, что клетки были разрезаны примерно на равные половины, мы включили жидкостные шунты сразу после ножа. Шунты помогли выровнять давление на двух выходах и избежать нарушения процесса резания, возникающего из-за изменения гидравлического сопротивления на выходе (22, 23).
Мы обнаружили, что нож из ПДМС был достаточно жестким и эффективным для разрезания Stentor , хотя ПДМС относительно мягкий (модуль Юнга ~500 кПа). Во всех наших экспериментах мы не наблюдали деформации самого ПДМС.Хотя мы не измеряли модуль Юнга Stentor , мы ожидаем, что его значение будет близко к значению одноклеточного Dictyostelium (∼1–8 кПа) (21), что примерно в 100 раз меньше, чем у PDMS. Для облегчения эффективного разрезания Stentor мы использовали каналы с размерами меньше размера клетки (таблица S1). Это ограничение гарантировало, что клетки будут разрезаны ножом, и предотвратило их обход ножом и попадание в один из выходов без разреза.Чтобы убедиться, что клетки были разрезаны примерно на равные половины, мы включили жидкостные шунты сразу после ножа. Шунты помогли выровнять давление на двух выходах и избежать нарушения процесса резания, возникающего из-за изменения гидравлического сопротивления на выходе (22, 23).
Рис. 1.
Разработка и валидация устройства микрожидкостной гильотины и регенерации клеточных фрагментов. ( A ) Схема микрожидкостного гильотинного устройства. Красная рамка показывает детали области ножа.Размеры указаны в таблице S1. ( B ) Микрофотографии, показывающие временную последовательность потока ячейки Stentor в микроканале, деление ячейки ножом пополам и последующее разделение двух фрагментов ячейки на два отдельных выхода ниже по потоку. ( C ) Микрофотографии процесса регенерации (в момент времени t = 0, 4, 24 и 48 ч после разреза) двух клеточных фрагментов, полученных при разрезании одной клетки с помощью микрожидкостной гильотины. ( D ) Микрофотографии процесса регенерации (в моменты времени t = 0, 4, 24 и 48 ч после разреза) двух клеточных фрагментов, полученных при разрезании одной клетки стеклянной иглой вручную.Два фрагмента (указаны красной стрелкой при t = 0) хранились в двух отдельных лунках с PDMS. К t = 24–48 ч все клеточные фрагменты восстановили трубчатую форму. Синие стрелки указывают на пузырьки воздуха, которые со временем растворились.
( A ) Схема микрожидкостного гильотинного устройства. Красная рамка показывает детали области ножа.Размеры указаны в таблице S1. ( B ) Микрофотографии, показывающие временную последовательность потока ячейки Stentor в микроканале, деление ячейки ножом пополам и последующее разделение двух фрагментов ячейки на два отдельных выхода ниже по потоку. ( C ) Микрофотографии процесса регенерации (в момент времени t = 0, 4, 24 и 48 ч после разреза) двух клеточных фрагментов, полученных при разрезании одной клетки с помощью микрожидкостной гильотины. ( D ) Микрофотографии процесса регенерации (в моменты времени t = 0, 4, 24 и 48 ч после разреза) двух клеточных фрагментов, полученных при разрезании одной клетки стеклянной иглой вручную.Два фрагмента (указаны красной стрелкой при t = 0) хранились в двух отдельных лунках с PDMS. К t = 24–48 ч все клеточные фрагменты восстановили трубчатую форму. Синие стрелки указывают на пузырьки воздуха, которые со временем растворились. Видео регенерации для A и B показаны в фильмах S1 и S2 соответственно.
Видео регенерации для A и B показаны в фильмах S1 и S2 соответственно.
Таблица S1.
Экспериментальные параметры и диапазон значений, проверенных в данной работе
На рис. 1 B показаны изображения ячейки в процессе резки при расходе Q = 0.36 мл/ч. Процесс резки включает в себя три основных этапа. ( i ) Клетка соприкасается с кончиком ножа. ( ii ) Клетка распространяется на две ветви вниз по течению, но ее задний конец остается прикрепленным к кончику ножа. ( iii ) По мере того, как клетка продолжает распространяться вниз по течению, задний конец клетки на кончике ножа уменьшается в толщине и вытягивается в тонкую нить, которая в конечном итоге обрывается, и клетка разделяется на два фрагмента, которые текут вниз по течению отдельно.
Для проверки нашей микрогильотины на рис. 1 C показаны изображения регенерации двух клеточных фрагментов в разное время после того, как одна клетка была разрезана нашим устройством. На рис. 1 D показан аналогичный набор изображений из другой клетки, срезанной вручную с помощью стеклянной иглы. Смотрите фильмы S1 и S2 для соответствующих видео. Обе клетки, разрезанные нашим устройством и вручную, смогли выжить и восстановить нормальную морфологию в течение 24–48 часов. Типичная продолжительность клеточного цикла Stentor составляет 3 дня (24), и мы наблюдали, что клетки, разрезанные любым методом, выживали в течение по крайней мере 5 дней, после чего они часто подвергались клеточному делению с образованием новых клеток.Эти наблюдения показывают, что клетки восстановили важные признаки, указывающие на жизнеспособность.
На рис. 1 D показан аналогичный набор изображений из другой клетки, срезанной вручную с помощью стеклянной иглы. Смотрите фильмы S1 и S2 для соответствующих видео. Обе клетки, разрезанные нашим устройством и вручную, смогли выжить и восстановить нормальную морфологию в течение 24–48 часов. Типичная продолжительность клеточного цикла Stentor составляет 3 дня (24), и мы наблюдали, что клетки, разрезанные любым методом, выживали в течение по крайней мере 5 дней, после чего они часто подвергались клеточному делению с образованием новых клеток.Эти наблюдения показывают, что клетки восстановили важные признаки, указывающие на жизнеспособность.
Влияние прикладного вязкого напряжения на деформацию и выживание клеток.
На рис. 2 показано влияние подаваемого расхода при фиксированном угле лопасти 6°. Мы решили использовать этот угол лезвия, потому что нам удалось получить самую высокую выживаемость клеток на ~ 97% по сравнению с большими углами лезвия (рис. S1). Основываясь на данных о длине клеток и выживаемости, мы разделили поток на два режима: режим I ( v ≤ v c ) и режим II ( v > v c ), где v c ∼1.5 см/с.
S1). Основываясь на данных о длине клеток и выживаемости, мы разделили поток на два режима: режим I ( v ≤ v c ) и режим II ( v > v c ), где v c ∼1.5 см/с.
Рис. 2.
Характеристика влияния применяемой скорости потока на процесс резания и выживаемость клеток. ( A ) Схемы и микрофотографии, показывающие морфологию клетки в процессе резки при низкой скорости (режим I) и высокой скорости (режим II). В каждом случае клетки суспендировали в растворе метилцеллюлозы с концентрацией 0,2% масс./об. или 0,5% масс./об. ( B ) Нормализованная длина растяжения клетки во время разрезания и ( C ) выживаемость клеток в зависимости от скорости клеток, измеренной непосредственно перед ножом.Синие и красные символы соответствуют экспериментам, проведенным в 0,2% и 0,5% растворах метилцеллюлозы соответственно. В B маркеры указывают среднее из 7 ячеек. В C маркеры указывают среднее значение от четырех до семи клеток из каждого из трех отдельных экспериментов (или всего >15 клеток из всех экспериментов). Высота полосы погрешности представляет собой одно стандартное отклонение от среднего значения. Ширина полосы погрешности представляет собой одно стандартное отклонение от средней скорости клеток при фиксированной скорости потока, подаваемой из шприцевого насоса.
Высота полосы погрешности представляет собой одно стандартное отклонение от среднего значения. Ширина полосы погрешности представляет собой одно стандартное отклонение от средней скорости клеток при фиксированной скорости потока, подаваемой из шприцевого насоса.
Рис. S1.
Влияние угла наклона лезвия. Снимки клеток, срезанных ножом с углом лезвия ( A ) θ = 6°, ( B ) θ = 40° и ( C ) θ = 122° соответственно. ( D ) Нормализованная максимальная длина растяжения εmax клеточного фрагмента имеет тенденцию к увеличению с увеличением угла лезвия. Маркер представляет собой среднее значение по крайней мере трех вырезанных клеток, а высота полосы погрешности представляет собой одно стандартное отклонение от среднего значения. ( E ) Выживаемость клеток снижалась с увеличением угла лезвия.Каждый маркер представляет собой среднее значение выживаемости 12 срезанных клеток, а высота полосы погрешности представляет собой одно стандартное отклонение от среднего значения. Пунктирные линии в D и E предназначены только для визуального восприятия.
Пунктирные линии в D и E предназначены только для визуального восприятия.
В режиме I вязкое напряжение было низким. Клетки охватили всю ширину канала до, во время и по завершении разреза (рис. 2 A и фильмы S3 и S4). Ячейка не претерпела больших деформаций. Максимальная длина растяжения была небольшой, εmax≲2 (рис.2 В ). В этой статье сообщаемые длины удлинения были нормализованы к длине главной оси неразрезанной клетки до того, как она коснулась ножа ( Материалы и методы ). Кроме того, клетки всегда расщеплялись на кончике ножа на два клеточных фрагмента примерно одинакового размера. Разница в размере двух фрагментов составляла в среднем 10–16% от среднего размера двух клеточных фрагментов. Хотя мы не всегда могли отличить мембрану от клеточного содержимого с помощью нашей установки для визуализации, мембрана, по-видимому, разрывалась только на кончике ножа в конце процесса разрезания в большинстве разрезов.Содержимое ячейки обычно оставалось внутри ячейки в течение всего процесса. Выживаемость клеток превышала 90% (рис. 2 C ).
Выживаемость клеток превышала 90% (рис. 2 C ).
В режиме II приложенная скорость потока и, следовательно, вязкое напряжение, испытываемое клетками, увеличилось. Отличные от режима I изменения морфологии клетки мы наблюдали в процессе резания. Если до разреза клетки занимали всю ширину канала, то во время разреза они сильно растянулись и не охватили всю ширину канала до завершения разреза (рис.2 A и фильм S5). Разрыв мембраны больше не ограничивался задним концом клетки на кончике ножа. Мембрана часто рвалась в нескольких местах ниже по течению от ножа, что приводило к выплескиванию клеточного содержимого. Длина растяжения увеличивалась со скоростью, достигая εmax ∼3 (рис. 2 B ). Поскольку мы не могли легко идентифицировать клеточную мембрану, указанное здесь увеличение длины растяжения было вызвано как увеличением деформации мембраны, так и увеличением вытекания клеточного содержимого.По мере увеличения скорости клетки также имели тенденцию к разделению на два или более фрагментов в случайных местах ниже по течению от кончика ножа. Таким образом, размеры фрагментов были менее однородными, чем фрагменты, вырезанные в режиме I. Соответствующая выживаемость клеток также снизилась с почти 100% до примерно 60% (рис. 2 C ).
Таким образом, размеры фрагментов были менее однородными, чем фрагменты, вырезанные в режиме I. Соответствующая выживаемость клеток также снизилась с почти 100% до примерно 60% (рис. 2 C ).
В нашей конструкции есть два возможных источника напряжения, которые могут действовать вместе, чтобы разрезать ячейку. Первый источник возникает из-за того, что жидкость толкает клетку перпендикулярно ножу.Этот стресс может привести к режущему механизму, при котором кончик ножа проникает в клеточную мембрану с последующим разделением содержимого клетки на две половины. Второй источник — вязкие напряжения, создаваемые обтеканием ячейки. Это напряжение имеет тенденцию приводить к разрыву мембраны. В зависимости от подробной локальной гидродинамики и механических свойств ячейки разрыв может произойти на кончике лезвия или в других частях ячейки.
В режиме I маловероятно, чтобы нож проник в клеточную мембрану при первом контакте.Вместо этого часто наблюдали, как клетки оборачиваются вокруг лезвия ножа, не будучи изначально проколотыми. По мере того, как клетка продолжала двигаться вниз по течению, мембрана на ее заднем конце растягивалась и, в конце концов, отщипывалась на кончике ножа (видео S4). Защемление было вызвано главным образом вязким напряжением вблизи кончика ножа. Степень разрыва мембраны оказалась относительно небольшой и ограничивалась только задним концом клетки (рис. S2). В режиме II давление, оказываемое ножом на клетку при применяемых скоростях потока, могло приблизиться к необходимому для проникновения через мембрану.Таким образом, стало возможным, что нож проколол мембрану, когда клетка впервые контактировала с ножом, хотя для проверки этого процесса потребуется улучшенная установка визуализации. Тем не менее, в этом режиме высокое вязкое напряжение, испытываемое клеткой, приводило к увеличению растяжения клетки и вызывало разрывы мембраны во многих местах ниже по течению от кончика ножа. Из этих разрывов возникал преобладающий способ разрезания клеток, что приводило к расщеплению клетки на фрагменты разного размера с обширным выплескиванием цитоплазмы.
По мере того, как клетка продолжала двигаться вниз по течению, мембрана на ее заднем конце растягивалась и, в конце концов, отщипывалась на кончике ножа (видео S4). Защемление было вызвано главным образом вязким напряжением вблизи кончика ножа. Степень разрыва мембраны оказалась относительно небольшой и ограничивалась только задним концом клетки (рис. S2). В режиме II давление, оказываемое ножом на клетку при применяемых скоростях потока, могло приблизиться к необходимому для проникновения через мембрану.Таким образом, стало возможным, что нож проколол мембрану, когда клетка впервые контактировала с ножом, хотя для проверки этого процесса потребуется улучшенная установка визуализации. Тем не менее, в этом режиме высокое вязкое напряжение, испытываемое клеткой, приводило к увеличению растяжения клетки и вызывало разрывы мембраны во многих местах ниже по течению от кончика ножа. Из этих разрывов возникал преобладающий способ разрезания клеток, что приводило к расщеплению клетки на фрагменты разного размера с обширным выплескиванием цитоплазмы.
Рис. S2.
Размер раны через 1 мин после разрезания клетки в ( А ) режиме I при скорости клетки = 0,70 см/с и ( В ) режиме II при скорости клетки = 8,38 см/с. Для проведения этих экспериментов мы инкубировали клетки в растворе DiBAC4(3) в PSW (5 мкМ) в течение 5 минут перед разрезанием клеток [см. основной текст и SI Materials and Methods для получения других сведений о DiBAC4(3) анализ]. Затем клетки разрезали на микрожидкостной гильотине непосредственно в этом растворе.Мы остановили поток после того, как клетка была разрезана, и визуализировали срезанные клетки в течение 1 минуты после разреза в том же канале, который состоял из большой камеры визуализации после ножа. По сравнению с анализом, представленным на рис. 3, инкубация клеток в DiBAC4(3) до их разрезания позволяла молекулам DiBAC4(3) диффундировать в клетку сразу после разрезания клеток. Полученная флуоресценция DiBAC4(3) может лучше отражать степень разрыва мембраны в процессе разрезания. Отметим, однако, что абсолютное распределение интенсивности флуоресценции зависит также от локальной диффузионной способности молекул DiBAC4(3), а также от локальной концентрации внутриклеточных белков, с которыми ассоциирует DiBAC4(3). Таким образом, трудно количественно определить фактический размер разрыва мембраны во время разреза на основе абсолютного распределения интенсивности флуоресценции. Тем не менее, в режиме I, если бы нож проник через клеточную мембрану и таким образом расколол клетку, можно было бы ожидать увидеть большую рану, обнажающую половину цитоплазмы. Затем DiBAC4(3) мог легко диффундировать в клетку. Возникающая в результате флуоресценция DiBAC4(3) должна распространяться на большую часть разрезанной клетки. Однако, как показано на изображениях, мы заметили, что размер раны был относительно небольшим и локализованным.В некоторых случаях мы не наблюдали никакой флуоресценции. Кроме того, в процессе разрезания мы не наблюдали вытекания цитоплазмы до тех пор, пока почти вся длина клетки не попала в два выходных канала. Напротив, для клеток, разрезанных в режиме II, флуоресценция распространялась почти на всю разрезанную клетку. Такие результаты согласуются с расширенной степенью разрыва мембраны в режиме II.
Таким образом, трудно количественно определить фактический размер разрыва мембраны во время разреза на основе абсолютного распределения интенсивности флуоресценции. Тем не менее, в режиме I, если бы нож проник через клеточную мембрану и таким образом расколол клетку, можно было бы ожидать увидеть большую рану, обнажающую половину цитоплазмы. Затем DiBAC4(3) мог легко диффундировать в клетку. Возникающая в результате флуоресценция DiBAC4(3) должна распространяться на большую часть разрезанной клетки. Однако, как показано на изображениях, мы заметили, что размер раны был относительно небольшим и локализованным.В некоторых случаях мы не наблюдали никакой флуоресценции. Кроме того, в процессе разрезания мы не наблюдали вытекания цитоплазмы до тех пор, пока почти вся длина клетки не попала в два выходных канала. Напротив, для клеток, разрезанных в режиме II, флуоресценция распространялась почти на всю разрезанную клетку. Такие результаты согласуются с расширенной степенью разрыва мембраны в режиме II.
Переход с I режима на II.
Определение пороговой скорости имеет непосредственное практическое значение при выборе геометрии канала и экспериментальных условий.Поскольку выживаемость клеток быстро снижалась в режиме II, максимальная скорость разрезания клеток для достижения высокой производительности разрезания при сохранении жизнеспособности клеток находится на пороговой скорости, когда режим I переходит в режим II.
Чтобы выяснить, почему переход произошел при скорости v c ∼1,5 см/с, потребуется дополнительная характеристика механических свойств Stentor . Свойства клеточной мембраны и клеточного содержимого сильно нелинейны, анизотропны и гетерогенны и являются активной областью исследований (25, 26).Интересно, что мы обнаружили, что морфология ячейки во время разреза была аналогична морфологии истончающейся при сдвиге вязкоупругой капли, которая также демонстрировала переход от режима I к режиму II, когда мы увеличивали скорость потока выше критической скорости (рис. С3). Такое сходство предполагает, что критическая скорость для разрезания клетки в нашем устройстве, возможно, может быть смоделирована без учета всей сложной внутренней структуры и реологии клетки.
С3). Такое сходство предполагает, что критическая скорость для разрезания клетки в нашем устройстве, возможно, может быть смоделирована без учета всей сложной внутренней структуры и реологии клетки.
Рис. S3.
Влияние скорости потока на истончение вязкоупругой капли. Капля состояла из раствора метилцеллюлозы (2% масс./об.), а непрерывная фаза состояла из HFE-7500, содержащего поверхностно-активное вещество EA (2% масс./масс.). Вязкость раствора капли с бесконечной скоростью была измерена, как описано в SI Materials and Methods , и составила 900 сП. ( A ) Снимки падения в режимах I и II. Определение двух режимов было таким же, как и в тексте для ячейки. ( B ) Длина удлинения капли как функция скорости капли.Заметим, что аналогичный переход формы капли происходил при увеличении расхода в ньютоновской капле, состоящей из воды или раствора глицерина (20 % мас./мас.), за исключением того, что в режиме II задний конец капли часто распадался на более мелкие капли вместо образуя длинную нить, свисающую с ножа.
Связь между деформацией клеток и выживанием.
Рис. 2 B и C показывают, что, как правило, удлинение или деформация клеток были обратно пропорциональны выживаемости.Увеличенный разброс данных в режиме II отражает то, что место деления клеток, количество и размер клеточных фрагментов и соответствующие размеры раны контролировались меньше, чем в режиме I. Связь между удлинением клеток и выживаемостью здесь следующая. качественно согласуется с предыдущей работой, в которой сообщалось, что большая деформация увеличивает напряжение на поверхности клетки и, следовательно, вероятность лизиса и гибели клеток (27, 28).
Существуют ключевые различия между ранее изученными клетками (например,g., клетки первичной аденомы предстательной железы человека и миобласты мыши) и Stentor , однако. Например, когда клеточная мембрана расширилась более чем на 50%, сообщалось, что жизнеспособность клеток первичной аденомы предстательной железы человека быстро снижается, о чем свидетельствует лизис клеток (27). Однако большинство из клеток Stentor выжило в режиме I, даже несмотря на то, что их нормализованная длина растяжения увеличилась до εmax ~2, что соответствует удвоению кажущейся площади его поверхности. Эта способность была частично обусловлена способностью Stentor деформироваться: мы и другие наблюдали, что Stentor может сокращаться на 20–25% своей растянутой длины за миллисекунды при механической стимуляции (29⇓–31).Оставшись нетронутым, Stentor возвращается в растянутое состояние через несколько секунд. Кроме того, Stentor выжил после расщепления на два фрагмента, в ходе которого мембрана должна была открыться (и, следовательно, клетка должна была «лизироваться»). Действительно, было обнаружено, что Stentor способен восстанавливать цитоплазму после разрыва мембраны и выживать впоследствии (32), а также выживать в экспериментах по пересадке, в которых две разрезанные клетки сливались вместе в месте надрезов (33, 34).
Однако большинство из клеток Stentor выжило в режиме I, даже несмотря на то, что их нормализованная длина растяжения увеличилась до εmax ~2, что соответствует удвоению кажущейся площади его поверхности. Эта способность была частично обусловлена способностью Stentor деформироваться: мы и другие наблюдали, что Stentor может сокращаться на 20–25% своей растянутой длины за миллисекунды при механической стимуляции (29⇓–31).Оставшись нетронутым, Stentor возвращается в растянутое состояние через несколько секунд. Кроме того, Stentor выжил после расщепления на два фрагмента, в ходе которого мембрана должна была открыться (и, следовательно, клетка должна была «лизироваться»). Действительно, было обнаружено, что Stentor способен восстанавливать цитоплазму после разрыва мембраны и выживать впоследствии (32), а также выживать в экспериментах по пересадке, в которых две разрезанные клетки сливались вместе в месте надрезов (33, 34). .Эти результаты, наряду с результатами, представленными в этой статье, показывают, что разрыв мембраны сам по себе не приводил к немедленной гибели клеток в Stentor .
.Эти результаты, наряду с результатами, представленными в этой статье, показывают, что разрыв мембраны сам по себе не приводил к немедленной гибели клеток в Stentor .
Тем не менее, клетки, подвергшиеся большой деформации в режиме II, также имели тенденцию к увеличению разрывов мембран, что приводило к увеличению утечки содержимого клеток. Мы считаем, что повышенная потеря клеточного содержимого в конечном итоге привела к снижению выживаемости клеток. Чтобы определить степень разрыва мембраны, мы использовали небольшой отрицательно заряженный флуорофор, бис-(1,3-дибутилбарбитуровая кислота)триметиноксонол [DiBAC4(3)], который обычно непроницаем для мембраны (35, 36).Он может проникать в деполяризованные клетки и связываться с внутриклеточными белками или мембранами, проявляя повышенную интенсивность флуоресценции.
На рис. 3 показано, что когда клетка была интактной, DiBAC4(3) не мог проникать через мембрану и почти не флуоресцировал. Когда клетку разрезали, ее мембрана разрывалась. Stentor , имеющий приблизительный мембранный потенциал покоя -50 мВ, стал деполяризованным (37). В то же время внутриклеточные белки подвергались воздействию среды, содержащей DiBAC4(3). Интенсивность флуоресценции DiBAC4(3) увеличилась по сравнению с интактными клетками.
Stentor , имеющий приблизительный мембранный потенциал покоя -50 мВ, стал деполяризованным (37). В то же время внутриклеточные белки подвергались воздействию среды, содержащей DiBAC4(3). Интенсивность флуоресценции DiBAC4(3) увеличилась по сравнению с интактными клетками.
Рис. 3.
Визуализация степени разрыва мембраны. ( A ) Светлопольное ( слева ) и флуоресцентное изображение DiBAC4(3) ( справа ) неразрезанных клеток Stentor , фрагмента клетки, разрезанного в режиме I, и фрагмента клетки, разрезанного в режиме II, соответственно . Эти клетки вырезали при условиях потока, указанных синими стрелками на фиг. 2 B и C . ( B ) Интенсивность флуоресценции DiBAC4(3) клеток, вырезанных в режиме I и в режиме II, где DiBAC4(3) добавляли сразу после разреза («0h») или через 24 часа после разреза («24h»).Интенсивность флуоресценции неразрезанных клеток показана в качестве эталона. Каждый маркер представляет данные для одной ячейки.
В целом, интенсивность флуоресценции должна увеличиваться с увеличением размера раны, поскольку больше DiBAC4(3) может проникнуть в клетку и взаимодействовать с внутриклеточными белками. Действительно, интенсивность флуоресценции DiBAC4(3) в клетках, разрезанных в режиме I, достоверно не отличалась от таковой в неразрезанных клетках. Напротив, интенсивность флуоресценции в клетках, разрезанных в режиме II, была в среднем в 20 раз выше, чем в неразрезанных клетках.Расположение флуоресценции также коррелировало с частью клетки, где мембрана, по-видимому, отсутствовала (рис. 3 A ). Эти наблюдения подтверждают, что размер раны был меньше, когда клетки разрезали при низковязком напряжении, чем при разрезании при высоком вязком напряжении, что согласуется с измеренными данными по удлинению клеток и выживаемости на фиг. 2 B и C .
Мы отмечаем, что разброс данных флуоресценции был больше в клетках, вырезанных в режиме II, чем в клетках, вырезанных в режиме I. Например, в том же эксперименте были клетки, флуоресценция которых в шесть раз превышала среднюю. Они соответствовали сильно поврежденным клеткам с явно нарушенными мембранами. Маловероятно, что эти клетки выжили, что отчасти подтверждается тем фактом, что фрагменты мертвых клеток, утратившие целостность мембраны, флуоресцировали даже сильнее, чем сильно поврежденные клетки. Были также клетки, которые демонстрировали низкую флуоресценцию (<1000 по абсолютной интенсивности флуоресценции, рис. 3 B ), аналогичную клеткам, вырезанным в режиме I.Эти клетки, вероятно, выжили. Мы подсчитали количество клеток с низким уровнем флуоресценции ( n = 20) по сравнению с клетками с высокой флуоресценцией ( n = 11), и процент клеток с низкой флуоресценцией составил около 64%. Это значение хорошо соответствовало 60% выживаемости в режиме II (рис. 2 C ).
Например, в том же эксперименте были клетки, флуоресценция которых в шесть раз превышала среднюю. Они соответствовали сильно поврежденным клеткам с явно нарушенными мембранами. Маловероятно, что эти клетки выжили, что отчасти подтверждается тем фактом, что фрагменты мертвых клеток, утратившие целостность мембраны, флуоресцировали даже сильнее, чем сильно поврежденные клетки. Были также клетки, которые демонстрировали низкую флуоресценцию (<1000 по абсолютной интенсивности флуоресценции, рис. 3 B ), аналогичную клеткам, вырезанным в режиме I.Эти клетки, вероятно, выжили. Мы подсчитали количество клеток с низким уровнем флуоресценции ( n = 20) по сравнению с клетками с высокой флуоресценцией ( n = 11), и процент клеток с низкой флуоресценцией составил около 64%. Это значение хорошо соответствовало 60% выживаемости в режиме II (рис. 2 C ).
Кроме того, мы провели тот же анализ на срезанных клетках через 24 часа. Сначала мы идентифицировали живые клетки ( Материалы и методы ), а затем измерили флуоресценцию этих клеток. Мы обнаружили, что все клетки, которые выжили, независимо от того, были ли они вырезаны в режиме I или II, имели низкий уровень флуоресценции. Этот результат указывает на то, что все клетки, выжившие после разреза, должны были также залечить разрывы мембраны в течение 24 часов.
Мы обнаружили, что все клетки, которые выжили, независимо от того, были ли они вырезаны в режиме I или II, имели низкий уровень флуоресценции. Этот результат указывает на то, что все клетки, выжившие после разреза, должны были также залечить разрывы мембраны в течение 24 часов.
Самоочистка ножа и увеличение производительности резки.
После разрезания мы заметили, что остатки клеток иногда оставались на кончике ножа (рис. 4 A ). Это наблюдение было похоже на то, что сообщалось в предыдущих исследованиях расщепления капель мимо препятствия (т.г., столб) в русле, где перед препятствием при определенных условиях течения оставался небольшой остаточный перепад (38, 39). Оставленный клеточный остаток был значительно меньше размера клетки (<10% от размера неразрезанной клетки). Эта потеря клеточной массы, по-видимому, не нарушала заживления и регенерации клеточных фрагментов. Однако примерно после 5–10 разрезов нож затупился из-за накопления остатков клеток, которые также начали закупоривать каналы. Разрезание последующих клеток становилось затруднительным: клетки либо протискивались через закупоренный канал и теряли большую часть своей цитоплазмы, либо застревали в ноже, тем самым еще больше закупоривая канал, либо опускались в одно отверстие, не разрезаясь.
Разрезание последующих клеток становилось затруднительным: клетки либо протискивались через закупоренный канал и теряли большую часть своей цитоплазмы, либо застревали в ноже, тем самым еще больше закупоривая канал, либо опускались в одно отверстие, не разрезаясь.
Рис. 4.
Самоочистка ножа с помощью капель и распараллеливания микрофлюидного гильотинного устройства. ( A ) Микрофотографии ножа после разрезания 1, 5 и 10 клеток соответственно для случаев, когда клетки не инкапсулированы внутри капель («-капли»), и когда клетки инкапсулированы внутри капель, содержащих 0,2% раствор метилцеллюлозы «МС» (мас./об.) («+капли»). ( B ) Микрофотографии, показывающие временную последовательность удаления остатков клеток каплями.( C ) Схема, показывающая конструкцию параллельного микрожидкостного гильотинного устройства, содержащего восемь параллельных генераторов капель с Т-образным соединением, где клетки инкапсулированы в капли, и восемь наборов ножей ниже по потоку. ( C , Вставка ) Микрофотографии, показывающие срезанную клетку внутри капли, собранной на выходе из устройства. Капли могут быть впоследствии объединены, а фрагменты клеток могут быть собраны и отображены из капель. ( D ) Сравнение эффективности резания с использованием стеклянной иглы вручную, одного канала микрофлюидной гильотины и восьми параллельных каналов, в которых клетки также инкапсулированы в капли.
( C , Вставка ) Микрофотографии, показывающие срезанную клетку внутри капли, собранной на выходе из устройства. Капли могут быть впоследствии объединены, а фрагменты клеток могут быть собраны и отображены из капель. ( D ) Сравнение эффективности резания с использованием стеклянной иглы вручную, одного канала микрофлюидной гильотины и восьми параллельных каналов, в которых клетки также инкапсулированы в капли.
Чтобы получить достаточное количество клеток (>100) для таких исследований, как секвенирование РНК, был необходим метод очистки ножа. Мы обнаружили, что инкапсуляция Stentor в водные капли перед разрезанием способствует самоочищению ножа ( SI Materials and Methods и Movie S6). Поверхностное натяжение между водной средой и маслом способствовало удержанию клеточных фрагментов внутри капли, тем самым предотвращая скопление остатков на ноже (рис.4 В ). Рис. 4 A показывает, что нож оставался чистым после 10 надрезов, когда клетки были инкапсулированы в капли, тогда как значительное количество остатков клеток накапливалось после 10 надрезов, когда клетки не были в каплях. Примечательно, что мы отмечаем, что возможность инкапсулировать и разрезать клетки в каплях делает наш метод напрямую совместимым с подготовкой библиотеки клеток в каплях для секвенирования одноклеточной РНК и других подходов к секвенированию следующего поколения на основе капель.
Примечательно, что мы отмечаем, что возможность инкапсулировать и разрезать клетки в каплях делает наш метод напрямую совместимым с подготовкой библиотеки клеток в каплях для секвенирования одноклеточной РНК и других подходов к секвенированию следующего поколения на основе капель.
В предыдущих разделах мы определили пороговую скорость, выше которой жизнеспособность клеток быстро снижалась при переходе от режима I к режиму II.Эта пороговая скорость устанавливает самую высокую скорость для разрезания одной клетки, независимо от того, инкапсулирована она внутри капли или нет. При концентрации клеток, использованной в наших экспериментах, мы достигли максимальной производительности резки около восьми клеток в минуту в одной микрогильотине. Для дальнейшего увеличения производительности мы разработали устройство, состоящее из восьми параллельных генераторов капель, за каждым из которых следует нож (рис. 4 C и рис. S4). Используя это параллельное устройство, мы достигли производительности резания 64 клеток в минуту, что более чем в 200 раз быстрее, чем при резке клеток вручную (рис. 4 Д ). Поскольку время регенерации составляет около 10 часов (13), этой пропускной способности достаточно для создания достаточного количества клеточных фрагментов, которые относительно синхронизированы на стадии заживления и регенерации для последующих экспериментов по секвенированию РНК. Средняя выживаемость клеток, срезанных этим параллельным устройством, составила 94% (измерено в трех отдельных экспериментах), что аналогично максимальной выживаемости клеток, срезанных одним ножом.
4 Д ). Поскольку время регенерации составляет около 10 часов (13), этой пропускной способности достаточно для создания достаточного количества клеточных фрагментов, которые относительно синхронизированы на стадии заживления и регенерации для последующих экспериментов по секвенированию РНК. Средняя выживаемость клеток, срезанных этим параллельным устройством, составила 94% (измерено в трех отдельных экспериментах), что аналогично максимальной выживаемости клеток, срезанных одним ножом.
Рис. S4.
Скорость капель в восьми каналах параллельного микрожидкостного гильотинного устройства.1* представляет собой второе измерение скорости капель в канале 1 через ~30 мин после первого измерения. Горизонтальная линия представляет собой среднюю скорость капель в восьми каналах. Скорости капель были рассчитаны с использованием пользовательских сценариев MATLAB для отслеживания скорости капель в видеороликах, снятых с каждого канала.
SI Материалы и методы
Stentor и культуры водорослей.
Культуры S. coeruleus были получены от компании Carolina Biological Supply.Культуры выращивали в темноте при 20 °C в PSW, также полученном из Каролины, с семенами пшеницы (Ward’s Science) для стимулирования роста бактерий в качестве питательного вещества для Stentor . Кроме того, Stentor кормили водорослями Chlamydomonas reinhardtii . C. reinhardtii выращивали отдельно при постоянном комнатном освещении в среде TAP и дважды промывали PSW перед подачей на Stentor . Состав среды TAP был таким же, как сообщалось ранее (40).Культуре Stentor объемом 300 мл вводили ~3 × 10 7 клеток водорослей два раза в неделю.
Получение метилцеллюлозы и измерение вязкости.
Метилцеллюлоза была приобретена у Sigma-Aldrich (M0387). Мы вырезали клетки в водных растворах метилцеллюлозы, потому что высокая вязкость не позволяла Stentor всплывать вверх по течению в трубке шприца. Также было показано, что метилцеллюлоза безвредна для Stentor во время разрезания и регенерации (8). Метилцеллюлозу в PSW (2% мас./об.) готовили в виде маточного раствора следующим образом. Двести миллилитров PSW автоклавировали и одну треть этого объема добавляли в банку с мешалкой и нагревали выше 80 °C, затем добавляли 4,06 г метилцеллюлозы и перемешивали до диспергирования, после чего конечные две трети объема PSW был добавлен. После полного перемешивания раствор выдерживали при 4°C в течение 2 часов, а затем удаляли для использования. Для получения других концентраций метилцеллюлозы мы разбавляли 2% маточный раствор метилцеллюлозы PSW в отдельных емкостях.Затем эти разбавленные растворы смешивали 1:1 с PSW, содержащим Stentor . Конечные концентрации метилцеллюлозы, используемые во время резки, составляли 0,2% масс./об. и 0,5% масс./об. соответственно.
Метилцеллюлозу в PSW (2% мас./об.) готовили в виде маточного раствора следующим образом. Двести миллилитров PSW автоклавировали и одну треть этого объема добавляли в банку с мешалкой и нагревали выше 80 °C, затем добавляли 4,06 г метилцеллюлозы и перемешивали до диспергирования, после чего конечные две трети объема PSW был добавлен. После полного перемешивания раствор выдерживали при 4°C в течение 2 часов, а затем удаляли для использования. Для получения других концентраций метилцеллюлозы мы разбавляли 2% маточный раствор метилцеллюлозы PSW в отдельных емкостях.Затем эти разбавленные растворы смешивали 1:1 с PSW, содержащим Stentor . Конечные концентрации метилцеллюлозы, используемые во время резки, составляли 0,2% масс./об. и 0,5% масс./об. соответственно.
Для измерения вязкости растворов метилцеллюлозы использовали реометр (ARES G-2; TA Instruments), снабженный конусной пластиной диаметром 40 мм с углом наклона 2°. Для расчета зависимости вязкости среды от скорости сдвига при резке Stentor при различных скоростях потока мы использовали метод Сона (41) для расчета скорости потока, который дает эквивалентную скорость сдвига параллельных пластин. Для скоростей и соответствующих скоростей сдвига, используемых в наших экспериментах, вязкость находилась в диапазоне от ~2,9 до 9 сП для 0,2% раствора метилцеллюлозы и от ~8,2 сП до 18 сП для 0,5% раствора метилцеллюлозы.
Для скоростей и соответствующих скоростей сдвига, используемых в наших экспериментах, вязкость находилась в диапазоне от ~2,9 до 9 сП для 0,2% раствора метилцеллюлозы и от ~8,2 сП до 18 сП для 0,5% раствора метилцеллюлозы.
Изготовление микроканалов и введение клеток в каналы.
Мы использовали стандартные методы мягкой литографии для изготовления всех микрожидкостных устройств с использованием соотношения основы и отвердителя 10:1 из набора силиконовых эластомеров Sylgard 184 (Dow Corning). Чтобы предотвратить застревание пузырьков воздуха в канале, особенно в шунтах, мы вводили в каналы деионизированную воду после плазменной сварки и держали каналы в водяной бане, чтобы сохранить их гидрофильными до использования в течение 5 часов после фиксации.Входы и выходы устройства PDMS имели диаметр 1 мм, а ширина канала плавно сужалась между входом (или выходом) и ножом.
Для введения клеток в устройство клетки сначала переносили из культуры в пробирку Эппендорфа с помощью пипетки. Затем клетки концентрировали на дне пробирки с помощью центрифугирования при 24 × g в течение 4 мин. Низкая скорость вращения использовалась, чтобы избежать повреждения клеток. Концентрированные клетки переносили в полиэтиленовые трубки, соединенные со шприцем, предварительно загруженным PSW, содержащим метилцеллюлозу.Шприцевой насос (Kent Scientific) использовали для введения клеток в наше устройство с фиксированной скоростью потока. Минимальную скорость потока выбирали таким образом, чтобы Stentor можно было протолкнуть через трубку, соединяющую шприц и микроканалы. Если скорость потока была слишком низкой, клеток Stentor могли плыть вверх по течению или застаивались в трубке.
Затем клетки концентрировали на дне пробирки с помощью центрифугирования при 24 × g в течение 4 мин. Низкая скорость вращения использовалась, чтобы избежать повреждения клеток. Концентрированные клетки переносили в полиэтиленовые трубки, соединенные со шприцем, предварительно загруженным PSW, содержащим метилцеллюлозу.Шприцевой насос (Kent Scientific) использовали для введения клеток в наше устройство с фиксированной скоростью потока. Минимальную скорость потока выбирали таким образом, чтобы Stentor можно было протолкнуть через трубку, соединяющую шприц и микроканалы. Если скорость потока была слишком низкой, клеток Stentor могли плыть вверх по течению или застаивались в трубке.
В экспериментах, в которых клеток Stentor были разрезаны на капли, мы получили капли вода-в-масле с помощью Т-образного соединения (42).Дисперсная фаза представляла собой суспензию клеток (∼3000 клеток/мл) в растворе метилцеллюлозы (0,2% мас./об.) в PSW. Непрерывная фаза состояла из смеси 47,5% об. /об. HFE-7500 (3M) и 52,5% об./об. FC-40 (3M), содержащей EA-сурфактант (2% вес./вес.) в качестве биосовместимого поверхностно-активного вещества (43). Мы использовали Aquapel, чтобы сделать каналы гидрофобными, чтобы предотвратить смачивание стенок каплями. Для выделения клеток из капель проводили серийное 4-кратное разведение непрерывной фазы 1 мл чистого HFE-7500 для разбавления стабилизирующего капли поверхностно-активного вещества.Капли немедленно сливались, и водную фазу пипеткой переносили в ванну с PSW (~3 мл) в 1-дюймовой чашке Петри для визуализации.
/об. HFE-7500 (3M) и 52,5% об./об. FC-40 (3M), содержащей EA-сурфактант (2% вес./вес.) в качестве биосовместимого поверхностно-активного вещества (43). Мы использовали Aquapel, чтобы сделать каналы гидрофобными, чтобы предотвратить смачивание стенок каплями. Для выделения клеток из капель проводили серийное 4-кратное разведение непрерывной фазы 1 мл чистого HFE-7500 для разбавления стабилизирующего капли поверхностно-активного вещества.Капли немедленно сливались, и водную фазу пипеткой переносили в ванну с PSW (~3 мл) в 1-дюймовой чашке Петри для визуализации.
Параллельная микрожидкостная гильотина Проектирование и изготовление.
Для параллельного микрожидкостного гильотинного устройства, содержащего восемь параллельных Т-образных генераторов капель и ножей, мы изготовили каналы в два слоя. Верхний слой служил для равномерного распределения масла по каждому из восьми каналов. Нижний слой служил для распределения дисперсной фазы, состоящей из водной суспензии Stentor . Мы применили поток к устройству таким образом, чтобы скорость в каждом из восьми каналов была примерно одинаковой и составляла v ~ 0,5 см/с (рис. S4). Мы отмечаем, что размер капель здесь не был монодисперсным, потому что присутствие клеток значительно модифицировало поток в Т-образном соединении, где клетки были инкапсулированы в капли. Однако для наших экспериментов монодисперсность капель не имела значения.
Мы применили поток к устройству таким образом, чтобы скорость в каждом из восьми каналов была примерно одинаковой и составляла v ~ 0,5 см/с (рис. S4). Мы отмечаем, что размер капель здесь не был монодисперсным, потому что присутствие клеток значительно модифицировало поток в Т-образном соединении, где клетки были инкапсулированы в капли. Однако для наших экспериментов монодисперсность капель не имела значения.
Измерение длины удлинения клетки.
Мы отмечаем, что при некоторых условиях потока клеточная мембрана разрывалась во время разреза, и содержимое клетки выливалось из клетки до того, как разрез был завершен.Однако измерение длины удлинения не позволяло различить клеточную мембрану и цитоплазму, отчасти из-за сложности дифференциации мембраны от содержимого клетки с использованием нашей установки для визуализации.
Заметим, что несколько ячеек, которые были слишком малы и не заполняли всю ширину канала до контакта с ножом, игнорировались. Поскольку остатки клеток, накапливающиеся на ноже примерно после пяти надрезов, могут изменить локальные условия потока, мы не измеряли длину удлинения после первых пяти надрезов в каждом устройстве. Также отметим, что при высоких скоростях в режиме II некоторые крупные ячейки немного выходили за пределы поля зрения до завершения разреза (примерно одна из трех ячеек в эксперименте, проведенном при максимальном приложенном потоке). В этих случаях мы не смогли измерить εmax, и такие клетки не были включены в наш анализ. Кроме того, некоторые клетки были заметно разрушены до их контакта с ножом при высоких скоростях (обычно менее 1 из ∼15 клеток на эксперимент в условиях режима I, но до 7 из 18 клеток в режиме II для точки данных). v = 4.48 см/с при концентрации метилцеллюлозы 0,5% мас./об.; для точек данных при концентрации метилцеллюлозы 0,2% мас./об. в режиме II преждевременный разрыв был менее частым на 2 из 16 клеток и 3 из 20 клеток для v = 6,73 см/с и 25,22 см/с соответственно) . Эти разорванные клетки, как правило, были повреждены на входе в устройство PDMS, где клетки были вынуждены войти из трубки большого диаметра в канал микромасштаба. Поскольку такое повреждение не было вызвано ножом PDMS, мы исключили такие предварительно поврежденные клетки в нашем анализе.
Также отметим, что при высоких скоростях в режиме II некоторые крупные ячейки немного выходили за пределы поля зрения до завершения разреза (примерно одна из трех ячеек в эксперименте, проведенном при максимальном приложенном потоке). В этих случаях мы не смогли измерить εmax, и такие клетки не были включены в наш анализ. Кроме того, некоторые клетки были заметно разрушены до их контакта с ножом при высоких скоростях (обычно менее 1 из ∼15 клеток на эксперимент в условиях режима I, но до 7 из 18 клеток в режиме II для точки данных). v = 4.48 см/с при концентрации метилцеллюлозы 0,5% мас./об.; для точек данных при концентрации метилцеллюлозы 0,2% мас./об. в режиме II преждевременный разрыв был менее частым на 2 из 16 клеток и 3 из 20 клеток для v = 6,73 см/с и 25,22 см/с соответственно) . Эти разорванные клетки, как правило, были повреждены на входе в устройство PDMS, где клетки были вынуждены войти из трубки большого диаметра в канал микромасштаба. Поскольку такое повреждение не было вызвано ножом PDMS, мы исключили такие предварительно поврежденные клетки в нашем анализе. Предварительного повреждения клеток перед ножом не наблюдалось в параллельных каналах, в которых использовались капли.
Предварительного повреждения клеток перед ножом не наблюдалось в параллельных каналах, в которых использовались капли.
Измерение ровности реза.
Для измерения ровности среза анализировали разницу в площади каждого фрагмента среза. Мы не измеряли ровность среза в режиме II, потому что клетка часто распадалась на несколько фрагментов после разрезания, и было неясно, какой из них выживет, если вообще будет. Для измерения площади вырезанного фрагмента использовались встроенные функции MATLAB для преобразования каждого видеокадра в бинарное изображение, в котором основная часть ячейки идентифицировалась как область со связанными белыми пикселями.Пользовательский сценарий использовался для обнаружения кадра, в котором ячейка разделялась на две отдельные области. Затем были получены площади в пикселях двух областей.
Измерение скорости клеток и капель.
Для измерения скорости клеток перед ножом перед разрезом мы сначала обрезали каждый видеокадр перед ножом. Затем мы отследили центроид каждой идентифицированной области в MATLAB и рассчитали скорость, разделив смещение центроида на охваченные кадры.Этот метод также использовался для измерения скорости капель на рис. S4.
Затем мы отследили центроид каждой идентифицированной области в MATLAB и рассчитали скорость, разделив смещение центроида на охваченные кадры.Этот метод также использовался для измерения скорости капель на рис. S4.
Анализ DiBAC4(3).
DiBAC4(3) был приобретен в компании Thermo Fisher. Исходный раствор готовили в деионизированной воде с концентрацией 50 мкМ. Для проведения анализа мы использовали микрожидкостное гильотинное устройство для разрезания клеток Stentor в растворе метилцеллюлозы (0,2% масс./об.) без DiBAC4(3) и собирали клетки в пробирку Эппендорфа. Во всех случаях разрезание клеток занимало менее 5 мин.
Для экспериментов по определению степени повреждения от порезов мы перенесли 200 мкл срезанных клеток в новую пробирку Эппендорфа сразу после разреза.Затем мы добавили 22 мкл раствора DiBAC4(3) с концентрацией 50 мкМ до достижения конечной концентрации DiBAC4(3) 5 мкМ. Для экспериментов по измерению степени заживления ран через 24 ч 200 мкл срезанных клеток инкубировали при 20°С в темноте. Через 24 часа мы добавили 22 мкл раствора DiBAC4(3) с концентрацией 50 мкМ до достижения конечной концентрации DiBAC4(3) 5 мкМ. После добавления DiBAC4(3) пробирку защищали от света, накрывая алюминиевой фольгой, и инкубировали в течение 15 мин. Мы выбрали 15 минут, потому что длительная инкубация (более 4 часов) вызывала флуоресценцию интактных клеток.После 15 минут инкубации с DiBAC4(3) клетки инъецировали в микролунку PDMS высотой 100 мкм, связанную с покровным стеклом, которое уже было заполнено 0,2% раствором метилцеллюлозы в PSW, содержащим DiBAC4(3) в концентрации 5 мкМ. . Светлое поле и флуоресцентные изображения каждой клетки получали в течение 10 минут с использованием эпифлуоресцентного микроскопа (Nikon Ti-U), оснащенного ПЗС-камерой с электронным умножением (Andor), через объектив микроскопа 20× (N.A. 0,4). DiBAC4(3) имеет пик возбуждения при 490 нм и пик испускания при 516 нм.Мы использовали фильтр возбуждения с центром пропускания на 470 нм и фильтр излучения с центром пропускания на 525 нм.
Через 24 часа мы добавили 22 мкл раствора DiBAC4(3) с концентрацией 50 мкМ до достижения конечной концентрации DiBAC4(3) 5 мкМ. После добавления DiBAC4(3) пробирку защищали от света, накрывая алюминиевой фольгой, и инкубировали в течение 15 мин. Мы выбрали 15 минут, потому что длительная инкубация (более 4 часов) вызывала флуоресценцию интактных клеток.После 15 минут инкубации с DiBAC4(3) клетки инъецировали в микролунку PDMS высотой 100 мкм, связанную с покровным стеклом, которое уже было заполнено 0,2% раствором метилцеллюлозы в PSW, содержащим DiBAC4(3) в концентрации 5 мкМ. . Светлое поле и флуоресцентные изображения каждой клетки получали в течение 10 минут с использованием эпифлуоресцентного микроскопа (Nikon Ti-U), оснащенного ПЗС-камерой с электронным умножением (Andor), через объектив микроскопа 20× (N.A. 0,4). DiBAC4(3) имеет пик возбуждения при 490 нм и пик испускания при 516 нм.Мы использовали фильтр возбуждения с центром пропускания на 470 нм и фильтр излучения с центром пропускания на 525 нм. Во время визуализации использовалось время экспозиции 0,05 с, чтобы избежать фотообесцвечивания.
Во время визуализации использовалось время экспозиции 0,05 с, чтобы избежать фотообесцвечивания.
Выводы
Мы сообщили о демонстрации микрофлюидного гильотинного устройства для высокопроизводительного разрезания Stentor . Изучение динамики локального разрезания выявило два режима, при которых происходит разрезание клеток. В режиме I низкое вязкое напряжение заставляет клетку оборачиваться вокруг ножа, а расщепление клеток происходит на заднем конце клетки, где на кончике ножа отщипывается мембрана.Размер раны хорошо контролируется, а выживаемость клеток близка к 100%. В режиме II высокое вязкое напряжение вызывает обширную деформацию клетки. Мембрана часто разрывается в случайных местах, образуя множественные клеточные фрагменты с различными размерами раны. Жизнеспособность клеток быстро снижается. Пороговая скорость, при которой режим I переходит в режим II, определяет максимальную производительность резки при сохранении высокой жизнеспособности клеток. Параллельное использование микрогильотины увеличивает производительность до 64 ячеек в минуту, что на два порядка быстрее, чем при ручной резке. Таким образом, наш метод способен подготовить сотни клеток на относительно синхронизированной стадии их заживления ран, что по своей сути является динамическим и зависящим от времени процессом. Идентификация двух режимов резания с обширным разрывом мембраны и без него дает возможность исследовать заживление раны и регенерацию по отдельности. Возможность разрезать клетки внутри капель позволяет использовать существующие методы микрофлюидики капель для анализа последовательности следующего поколения.
Таким образом, наш метод способен подготовить сотни клеток на относительно синхронизированной стадии их заживления ран, что по своей сути является динамическим и зависящим от времени процессом. Идентификация двух режимов резания с обширным разрывом мембраны и без него дает возможность исследовать заживление раны и регенерацию по отдельности. Возможность разрезать клетки внутри капель позволяет использовать существующие методы микрофлюидики капель для анализа последовательности следующего поколения.
Визуализация мембраны в режиме реального времени во время разреза позволит определить положение и размер разрывов мембраны. Измерение механических свойств Stentor , таких как натяжение мембраны, позволит дополнительно прогнозировать реакцию клеток в процессе разрезания и будет определять конструкцию и дальнейшую разработку микрогильотины для повышенного контроля ранения.
Разработка стандартизированных инструментов и анализов имела решающее значение для прогресса в области заживления ран на уровне тканей, поскольку они позволяли сравнивать различные отклонения в образцах с одинаковыми размерами ран на аналогичных стадиях процесса восстановления. Наша микрожидкостная платформа представляет собой важный шаг к такому стандартизированному анализу и, как ожидается, заложит основу для понимания того, как отдельные клетки восстанавливают себя. Кроме того, должна быть возможность адаптировать нашу конструкцию микрогильотины к другим типам клеток. Для клеток размером несколько микрон и больше можно использовать метод мягкой литографии, который мы использовали для изготовления микроканала и ножа. Материал, который мы использовали, был эффективен для разрезания мягких клеток, таких как Stentor .Для ячеек с повышенной жесткостью можно использовать полимеры (например, поликарбонат) с более высоким модулем упругости, чем у ПДМС.
Наша микрожидкостная платформа представляет собой важный шаг к такому стандартизированному анализу и, как ожидается, заложит основу для понимания того, как отдельные клетки восстанавливают себя. Кроме того, должна быть возможность адаптировать нашу конструкцию микрогильотины к другим типам клеток. Для клеток размером несколько микрон и больше можно использовать метод мягкой литографии, который мы использовали для изготовления микроканала и ножа. Материал, который мы использовали, был эффективен для разрезания мягких клеток, таких как Stentor .Для ячеек с повышенной жесткостью можно использовать полимеры (например, поликарбонат) с более высоким модулем упругости, чем у ПДМС.
Материалы и методы
Анализ
Stentor Морфология во время резки.
Чтобы охарактеризовать процесс резки в микрофлюидном гильотинном устройстве, мы использовали высокоскоростную камеру (Phantom v7.3), установленную на инвертированном микроскопе с 5-кратным объективом, для записи видео процесса.
Для извлечения длины расширения ячеек мы использовали ImageJ.Мы определили длину растяжения как длину клеточного фрагмента, измеренную от кончика ножа до края клеточного фрагмента, наиболее удаленного от кончика ножа. Мы записывали максимальную длину растяжения каждого клеточного фрагмента в кадре непосредственно перед завершением разреза, определяемую как время, когда два клеточных фрагмента отделялись друг от друга. Затем максимальную длину выдвижения нормализовали к длине главной оси неразрезанного Stentor до того, как он коснулся ножа.В этой статье мы сообщаем нормализованную максимальную длину удлинения как εmax. См. Материалы и методы SI для более подробной информации.
Измерение выживаемости клеток после разреза.
Для количественной оценки количества клеток, выживших после разреза, мы собрали клеточные фрагменты из устройства в чашку Петри, содержащую пастеризованную родниковую воду (PSW). Морфологию клеток мы отслеживали вручную под стереомикроскопом со светлым полем. Поскольку мембрана Stentor распадается быстро после смерти, мы классифицируем клетку как живую и успешно регенерирующую, если ( i ) она восстановила целостность мембраны, демонстрируемую биением ресничек, и ( ii ) либо активно плавает или прикрепляется к поверхности в форме одноименной трубы через 24 часа после разреза, что является типичным временем для полной регенерации Stentor (8).На дно чашки Петри наносили сетку для облегчения подсчета живых клеток.
Поскольку мембрана Stentor распадается быстро после смерти, мы классифицируем клетку как живую и успешно регенерирующую, если ( i ) она восстановила целостность мембраны, демонстрируемую биением ресничек, и ( ii ) либо активно плавает или прикрепляется к поверхности в форме одноименной трубы через 24 часа после разреза, что является типичным временем для полной регенерации Stentor (8).На дно чашки Петри наносили сетку для облегчения подсчета живых клеток.
Для количественной оценки выживаемости мы измерили количество живых клеток через 24 часа после разреза, Npost-cut. Коэффициент выживаемости определяется как Npost-cut/2⋅Npre-cut, где Npre-cut — это количество клеток, введенных в устройство, подсчитанное вручную по видеозаписи процесса вырезания. В качестве эталона мы сравнили порезы с помощью нашего устройства с порезами, выполненными вручную, обычным методом ранения в предыдущих исследованиях регенерации (8).Для разрезания клеток вручную нагревали над пламенем стеклянный капилляр и вытягивали его в тонкую иглу (диаметр кончика ∼30 мкм), которую затем охлаждали до комнатной температуры перед разрезанием клетки, иммобилизованной в 2% масс. об. раствора метилцеллюлозы. Этот раствор был достаточно вязким, чтобы уменьшить движение клеток во время разрезания. После резки мы добавляли PSW для разбавления раствора метилцеллюлозы для последующего контроля регенерации.
об. раствора метилцеллюлозы. Этот раствор был достаточно вязким, чтобы уменьшить движение клеток во время разрезания. После резки мы добавляли PSW для разбавления раствора метилцеллюлозы для последующего контроля регенерации.
Благодарности
Мы благодарим курс физиологии морской биологической лаборатории 2014 г. в Вудс-Хоул, Массачусетс (при поддержке гранта NIH R13GM085967) за первоначальные обсуждения и эксперименты.Эта работа была поддержана грантом NSF MCB 1517089, Национальным институтом общих медицинских наук, грантом NIH T32GM008412 (для LRB), грантом NIH GM113602 (для WFM), стипендией Американского онкологического общества 126787-PF-14-180-01-DMC (для PS), грант NSF CAREER 1454542 (для SKYT) и грант NSF 1548297 (для LRB, JWK, WFM и SKYT). Часть этой работы была выполнена в Стэнфордском центре мягких и гибридных материалов и в Стэнфордском коллективном нанообъекте. Ответственность за содержание этой работы лежит исключительно на авторах и не обязательно отражает официальную точку зрения финансирующих организаций.
Сноски
Вклад авторов: L.R.B., W.F.M. и S.K.Y.T. проектное исследование; Л.Р.Б., Ю.Г. и Дж.В.К. проведенное исследование; P.S. предоставил новые реагенты/аналитические инструменты; Л.Р.Б., Ю.Г., Дж.В.К. и С.К.Ю.Т. проанализированные данные; и L.R.B., Y.G., JWK, P.S., WFM и S.K.Y.T. написал бумагу.
Авторы заявляют об отсутствии конфликта интересов.
Эта статья является прямой отправкой PNAS.
Эта статья содержит вспомогательную информацию в Интернете по адресу www.pnas.org/lookup/suppl/doi:10.1073/pnas.1705059114/-/DCSupplemental.
представляет порог предпочтения, порог безразличия и… апликада; escritos por expertos en sus áreas y, que a su vez, ayudará tanto a empresarios y académicos en la generación de conocimiento para la toma de solutiones en las organizaciones y que esto detone en lograr una mayor competitividad en las organizaciones.Los doce capítulos pertenecientes a esta libro fueron elaborados por Investigadores de diversas universidades colombianas y mexicanas como son: la Pontificia Universidad Javeriana, Universidad Autónoma de Nuevo León, Universidad de Colima, Universidad de Monterrey, Universidad de la Amazonia, Universidad Universidad , Автономный университет Агуаскальентеса, Мичоаканский университет Сан-Николас-де-Идальго и Национальный технологический университет Мексики.

Entre los diferentes tópicos se discuten существующий tres estudios que se enfocan al agrícola en países como México y Colombia, analizando la competitividad de la industria ganadera como de frutos del bosque o bayas (ягоды) a través de un enfoque sistémico, la cadena de valor и ла индустрия 4.0; bajo este ultimo enfoque se estudian las evidencias de dos researchaciones sobre los clústeres de tecnologías de información en Colima y el de salud en Baja California. Así también se aborda el estudio de la cadena de suministro en México con dos estudios; uno bibliométrico y otro empírico, aplicado en el Estado de Aguascalientes, donde en ambos se analiza como este fenómeno ha afectado los procesos producticos en Pymes Manufactureras y por lo tanto su desempeño. Del mismo modo, se estudian temas de cómo resiliencia y la empresa socialmente ответственный сын elementos importantes para lograr la competitividad.Por ultimo, se tienen tres propuestas donde presentan evidencias empíricas de cómo un sistema de flexibilidad en la producción y su optimización para lograr la competitividad en diferentes Industrias Manufactureras.
 А между тем, двери — одна из ключевых позиций любого столярного проекта. Эта позиция имеет массу аспектов: конструкция, дизайн, материал, шумоизоляция, фурнитура, и даже количество дверей на проекте, — все имеет значение.
А между тем, двери — одна из ключевых позиций любого столярного проекта. Эта позиция имеет массу аспектов: конструкция, дизайн, материал, шумоизоляция, фурнитура, и даже количество дверей на проекте, — все имеет значение.





 25
25 35
35 50
50 65
65 74
74 80
80